
【题目】ClO2是一种消毒杀菌效率高、二次污染小的水处理剂.实验室可通过以下反应制得ClO2:2KClO3+H2C2O4+H2SO4 ![]() 2ClO2↑+2CO2↑+K2SO4+2H2O.下列说法正确的是( )
2ClO2↑+2CO2↑+K2SO4+2H2O.下列说法正确的是( )
A.H2C2O4在反应中被还原
B.1 molKClO3参加反应有2mol电子转移
C.ClO2是氧化产物
D.KClO3在反应中得到电子
【答案】D
【解析】解:2KClO3+H2C2O4+H2SO4 ![]() 2ClO2↑+K2SO4+2CO2↑+2H2O(O均为﹣2价)中,Cl元素的化合价由+5价降低为+4价,C元素的化合价由+3价升高到+4价,
2ClO2↑+K2SO4+2CO2↑+2H2O(O均为﹣2价)中,Cl元素的化合价由+5价降低为+4价,C元素的化合价由+3价升高到+4价,
A.H2C2O4为还原剂,在反应中被氧化,故A错误;
B.1molKClO3参加反应有1mol×(5﹣4)=1mol,故B错误;
C.Cl元素的化合价由+5价降低为+4价,所以氯酸钾,其对应的产物ClO2是还原产物,故C错误;
D.Cl元素的化合价由+5价降低为+4价,所以氯酸钾得电子为氧化剂,故D正确;
故选D.
2KClO3+H2C2O4+H2SO4 ![]() 2ClO2↑+K2SO4+2CO2↑+2H2O(O均为﹣2价)中,Cl元素的化合价由+5价降低为+4价,C元素的化合价由+3价升高到+4价,以此来解答.
2ClO2↑+K2SO4+2CO2↑+2H2O(O均为﹣2价)中,Cl元素的化合价由+5价降低为+4价,C元素的化合价由+3价升高到+4价,以此来解答.


科目:高中化学 来源: 题型:
【题目】若(NH4)2SO4在强热时分解的产物是SO2、N2、NH3和H2O,则该反应中化合价发生变化和未发生变化的N原子数之比为( )
A.1:2
B.1:4
C.2:1
D.4:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空
(1)S2﹣中含有18个电子,画出S的原子结构示意图 .
(2)一水合氨(NH3H2O)是一种弱电解质,在水中可电离出铵根离子和氢氧根离子,试写出一水合氨的电离方程式 .
(3)正长石的组成可表示为KAlSi3Ox , 试根据化合价计算x= .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将大部分已经锈蚀(成分为Fe2O3)的废铁屑制备绿矾(FeSO47H2O),实验操作过程如下: 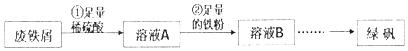
已知:杂质不溶于稀硫酸.
请回答下列问题:
(1)步骤①中,稀硫酸与Fe2O3反应的方程式为 , 废铁屑用硫酸处理后,还含有不溶性杂质,为获取澄清的A溶液,需进行的操作名称是 .
(2)步骤②中溶液A与铁粉反应的离子方程式为 .
(3)检验溶液B中是否还存在Fe3+的方法是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CuSO4溶液与K2C2O4溶液混合反应,产物之一是某种只含一种阴离子的蓝色钾盐水合物.通过下述实验确定该晶体的组成.
步骤a:称取0.6720g样品,放入锥形瓶,加入适量2molL﹣1稀硫酸,微热使样品溶解.再加入30mL水加热,用0.2000molL﹣1 KMnO4溶液滴定至终点,消耗8.00mLKMnO4溶液.
步骤b:接着将溶液充分加热,使淡紫红色消失,溶液最终呈现蓝色.冷却后,调节pH并加入过量的KI固体,溶液变为棕色并产生白色沉淀CuI.用0.2500molL﹣1 Na2S2O3标准溶液滴定至终点,消耗8.00mLNa2S2O3溶液.
已知涉及的部分反应的离子方程式为:
步骤a:2MnO4﹣+5C2O42﹣+16H+=2Mn2++8H2O+10CO2↑
步骤b:2Cu2++4I﹣=2CuI↓+I2 I2+2S2O32﹣=2I﹣+S4O62﹣
(1)已知室温下CuI的Ksp=1.27×10﹣12 , 欲使溶液中c(Cu+)≤1.0×10﹣6molL﹣1 , 应保持溶液中c(I﹣)≥molL﹣1 .
(2)MnO4﹣在酸性条件下,加热能分解为O2 , 同时生成Mn2+ .
写出该反应的离子方程式为 .
若无此加热操作,则测定的Cu2+的含量将会(填“偏高”、“偏低”或“不变”).
(3)步骤b用淀粉溶液做指示剂,则滴定终点观察到的现象为 .
(4)通过计算确定样品晶体的组成.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空
(1)Cu元素基态原子的电子排布式为 .
(2)元素N,O,S的第一电离能由大到小排列的顺序为 .
(3)S,Cl组成的一种化合物的分子结构与H2O2相似,则此化合物的结构式为 .
(4)Cu元素与H元素可形成一种红色晶体,其结构如图1,则该化合物的化学式为 .
(5)MgH2是金属氢化物储氢材料,其晶胞结构如图2所示,已知该晶体的密度agcm﹣3 , 则晶胞的体积为cm3[用a、NA表示阿伏加德罗常数]. 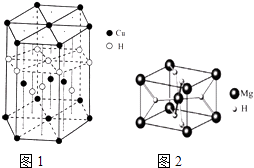
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将30ml 0.5mol/LNaOH溶液加水稀释到500ml,稀释后溶液中NaOH的物质的量浓度为( )
A. 0.3mol/L B. 0.03mol/L C. 0.05mol/L D. 0.04mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一未完成的离子方程式:( )+XO3﹣+6H+═3X2+3H2O,据此判断下列说法正确的是( )
A.X原子最外层有5个电子
B.当有1mol X2生成时,共有2mol电子转移
C.氧化产物和还原产物的物质的量之比为5:1
D.“( )”所填的微粒和XO3﹣在任何环境下都不能共存
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com