
【题目】下列说法正确的是
A. 甲烷和Cl2的反应与乙烯和Br2的反应属于同一有机反应类型
B. 单质硅是将太阳能转化为电能的常用材料
C. 淀粉、纤维素和油脂都属于天然高分子化合物
D. 合成纤维和光导纤维都是新型无机非金属材料
 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案科目:高中化学 来源: 题型:
【题目】下列除去杂质(括号的物质为杂质)的方法中,错误的是( )
A. FeCl3溶液(FeCl2):通入适量Cl2
B. CO(CO2):通过NaOH溶液洗气后干燥
C. Fe2O3(Al2O3):加入足量NaOH溶液
D. CO2(HCl):通过饱和Na2CO3溶液洗气后干燥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铬铁矿的主要成分可表示为FeO·Cr2O3,还含有MgO、Al2O3、Fe2O3等杂质,下图所示是以铬铁矿为原料制备重铬酸钾(K2Cr2O7)的工艺流程。
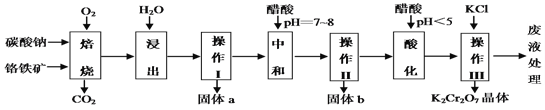
已知1:物质的溶解度(g/100g水)
物质 | 0℃ | 40℃ | 80℃ |
KCl | 28.0 | 40.1 | 51.3 |
NaCl | 35.7 | 36.4 | 38.0 |
K2Cr2O7 | 4.7 | 26.3 | 73.0 |
Na2Cr2O7 | 163.0 | 215.0 | 376.0 |
已知2:①焙烧时有Na2CrO4、 Fe2O3 、NaAlO2 等生成。
②Cr2O72- + H2O ![]() 2CrO42- + 2H+ ;
2CrO42- + 2H+ ;
③Cr2O72-具有很强的氧化性
回答问题:
(1)“浸出”步骤中,为了提高浸出率,可采取的措施有加热、研磨或_______________等(要求写一条)。
(2)固体b中主要含有______________________(填写化学式)。
(3)要检测酸化操作中溶液的pH是否等于4.5,应该使用_______(填写仪器或用品名称)。
(4)酸化步骤用醋酸调节溶液的pH﹤5,其目的是____________________;不用盐酸调节溶液pH的原因是______________________________________。
(5)操作III发生反应的化学方程式是____________________________ ;
(6)写出焙烧时生成NaAlO2的化学方程式____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列反应:①2Na+2H2O═2NaOH+H2↑ ②2F2+2H2O═4HF+O2③Cl2+H2O═HCl+HClO④2NaCl+2H2O ![]() 2NaOH+H2↑+Cl2↑⑤CaO+H2O═Ca(OH)2⑥CaCO3+H2O+CO2═Ca(HCO3)2
2NaOH+H2↑+Cl2↑⑤CaO+H2O═Ca(OH)2⑥CaCO3+H2O+CO2═Ca(HCO3)2
(1)其中水在反应中作氧化剂的反应是(填代号下同) .
(2)其中水在反应中作还原剂的反应是 .
(3)其中水在反应中既不作氧化剂也不作还原剂的反应是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲烷和水反应可以制水煤气(混合气体),其反应的微观示意图如图所示,根据以上微观示意图得出的结论中,正确的是( ) 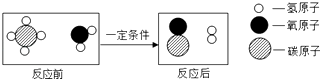
A.反应前后各元素的化合价均不变
B.水煤气的成分是一氧化碳和氧气
C.该反应中含氢元素的化合物有3种
D.该反应的化学方程式中甲烷和水的计量数之比为1:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知在稀溶液中,酸跟碱发生中和反应生成1 mol水时的反应热叫做中和热。现利用如图装置进行中和热的测定,请回答下列问题:

(1)图示装置有两处重要组成部分未画出,它们是____________ 、_______________。
(2)烧杯间填满碎泡沫塑料的作用是 ________________。
(3)若操作时分几次注入反应液,求得的反应热数值_____(填“偏大”“偏小”或“无影响”)。
(4)做一次完整的中和热测定实验,温度计需使用__________次。
(5)量取0.5 mol/L的盐酸和0.55 mol/L的NaOH溶液各50 mL进行实验,测得盐酸和NaOH溶液起始平均温度为t1℃,混合反应后最高温度为t2℃,设溶液密度均为1 g/mL,生成溶液的比热容c= 4.18 J/(g℃)。请列式计算中和热:△H= ______________kJ/mol(不用化简)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】KCl与KNO3在不同温度的溶解度数据如下表.则下列说法正确的是( )
温度/℃ | 10 | 20 | 30 | 40 | 50 |
KCl | 30g | 33g | 35g | 38g | 41g |
KNO3 | 21g | 31g | 45g | 65g | 88g |
A.KNO3比KCl的溶解度大
B.两种物质的溶解度相等的温度在20~30℃间
C.在20℃时,10g水中加入5gKCl可得到33.3% 的KCl溶液
D.在50℃时,两物质各5g分别加入l0g水中,充分溶解,均有固体剩余
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚氯酸钠(NaClO2)主要用于棉纺,造纸业的漂白,也用于食品消毒、水处理等。
已知:①亚氯酸钠(NaClO2)受热易分解。
②NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出NaClO2·3H2O;
③纯ClO2易分解爆炸,一般用稀有气体或空气稀释到10%以下安全。
以氯酸钠等为原料制备亚氯酸钠的工艺流程如下
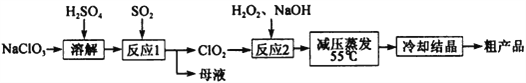
(1)“反应1”需要鼓入空气,空气的作用是 __________________________________。
(2)“反应2”的化学方程式为_________________________________。
(3)采取“减压蒸发”而不用“常压蒸发”,原因是___________________;结晶后需要对晶体洗涤,为了减少损失,可以用_____________ 洗涤晶体。
(4)从“母液”中可回收的主要物质是_____________ 。
(5)要得到纯的亚氯酸钠晶体(NaClO2·3H2O),对粗产品必须进行的操作为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分子式为C8H10的烃,含有苯环且苯环上一氯取代物只有一种(不考虑立体异构)的是( )
A. 乙苯 B. 邻二甲苯 C. 间二甲苯 D. 对二甲苯
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com