
| A. | H2SO4 | B. | Cl2 | C. | NaAlO2 | D. | NH3 |
分析 电解质是指在水溶液或熔化状态下能导电的化合物,而非电解质是指在水溶液和熔化状态下都不能导电的化合物.
解答 解:A.硫酸在水中能电离,则其水溶液导电,即硫酸属于电解质,故A错误;
B.因非电解质是化合物,而Cl2是单质,即Cl2既不是电解质也不是非电解质,故B错误;
C.因NaAlO2在水溶液或熔化状态下都能导电,则NaAlO2属于电解质,故C错误.
D.NH3的水溶液能导电,是因NH3和水反应生成一水合氨,一水合氨电离生成离子而导电,即发生电离不是NH3本身,故NH3属于非电解质,故D正确;
故选D.
点评 本题考查电解质和非电解质,学生应明确电解质和非电解质都是化合物,并明确判断电解质时发生电离的为化合物本身来分析解答即可.


科目:高中化学 来源: 题型:解答题
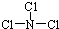 ,X 与水反应的化学方程式是NCl3+3H2O═NH3+3HClO.
,X 与水反应的化学方程式是NCl3+3H2O═NH3+3HClO.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠钾合金可用作快中子反应堆导热剂的原因之一是常温下呈液态 | |
| B. | 我国航天员穿的航天服使用的高强度、高韧性的特种尼龙,是一种有机高分子合成材料 | |
| C. | 硅主要以单质、氧化物、硅酸盐的形式存在于自然界中 | |
| D. | 用氢作汽车燃料,用燃料电池作动力,合成可再生的储氢材料,可以实现汽车的“零排放” |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
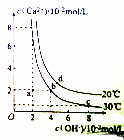
| A. | 20℃时,Ca(OH)2溶解度大于30℃时,Ca(OH)2的溶解度 | |
| B. | 30℃时,Ca(OH)2的饱和溶液中加入少量NaOH固体,Ca(OH)2的Ksp不变 | |
| C. | 30℃时,Ca(OH)2的Ksp等于3.2×10-5 | |
| D. | 20℃时,向Ca(OH)2的饱和溶液中加入少量CaO固体并维持温度不变,溶液的pH增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②④ | B. | ③⑥ | C. | ①③ | D. | ②⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com