
【题目】NA代表阿伏加德罗常数,下列说法正确的是
A. 3.2gO2和O3的混合物中含有的氧原子数目为0.2NA
B. 1L0.1mol·L-1的醋酸溶液中含有氢离子数目为0.1NA
C. 标准状况下,2.24LCCl4含碳原子数目为0.1NA
D. 将5.85 g NaCl固体溶解在100 mL水中,得到溶液中c(Na+)=1mol/L
 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案科目:高中化学 来源: 题型:
【题目】钠与水反应的实验过程如图①、②、③所示,下列有关说法不正确的是
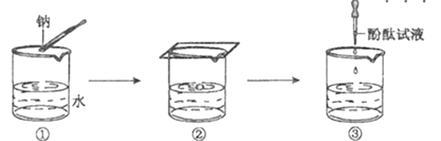
A. 图②中钠熔成小球,说明钠与水反应放热且钠的熔点低
B. 图②中钠四处游动并嘶嘶作响,说明反应产生了气体
C. 图③中滴加酚酞试液后溶液变红,说明有碱性物质生成
D. 钠与水反应的离子方程式是: 2Na+ 2H+=2Na+ + H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的值,下列说法不正确的是
A. 标准状况下3.6 g H2O含有的电子数为2NA
B. 2.8 g乙烯与聚乙烯的混合物含有的极性键为0.4NA
C. 0.l moI Cl2与足量的铁粉充分反应转移的电子数为0.2NA
D. 1 L 0.2 mol/l的K2Cr2O7溶液中![]() 的数目为0.2NA
的数目为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】方铅矿的主要成分为PbS,含铅可达86.6%。以方铅矿为原料制备铅蓄电池的电极材料PbO2的工艺流程如图所示:
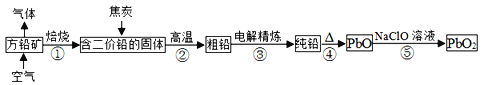
(1)方铅矿焙烧后排出气体的主要成分是______(填化学式),可用于工业制备________。
(2)步骤②中焦炭的作用是________。
(3)“粗铅”的杂质主要有锌、铁、铜、银等。电解精炼时,________作阴极,阴极反应式为________,阳极泥的主要成分是________。
(4)步骤⑤中制备PbO2的离子方程式________。
(5)已知:常温下,Ksp(PbS)=8×10-28、Ka1(H2S)=1.3×10-7、Ka2(H2S)=7.1×10-15。常温下,向Pb(NO3)2溶液中通入H2S气体,发生反应的离子方程式是________;结合数据分析,该反应能否进行得基本完全?________(写出计算推理过程)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组用下图所示装置制备气体(酒精灯可以根据需要选择),对应说法正确的是

选项 | ①中药品 | ②中药品 | ③中药品 | ④中药品 | 制备气体 | ⑥中药品及作用 |
A | 浓盐酸 | MnO2 | 饱和食盐水 | 浓硫酸 | C12 | NaOH溶液,尾气吸收 |
B | 稀硝酸 | Cu | 烧碱溶液 | 浓硫酸 | NO | Na()H溶液,尾气吸收 |
C | 浓盐酸 | 大理石 | 饱和Na2CO3溶液 | 浓硫酸 | CO2 | 澄清石灰水,检验CO2 |
D | 浓盐酸 | Zn | 水 | 浓硫酸 | H2 | 可撤去 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室中某些气体的制取、收集及尾气处理装置如图所示(省略夹持和净化装置)。仅用此装置和表中提供的物质完成相关实验,最合理的选项是

选项 | a中的物质 | b中的物质 | c中收集的气体 | d中的物质 |
A | 浓氨水 | CaO | NH3 | H2O |
B | 浓硫酸 | Na2SO3 | SO2 | NaOH溶液 |
C | 稀硝酸 | Cu | NO2 | H2O |
D | 浓盐酸 | MnO2 | Cl2 | NaOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现在污水治理越来越引起人们重视,可以通过膜电池除去废水中的乙酸钠和对氯苯酚( ![]() ),其原理如图所示,下列说法正确的是( )
),其原理如图所示,下列说法正确的是( )

A. 当外电路中有0.2mole―转移时,A极区增加的H+个数为0.2NA
B. A极的电极反应式为 ![]()
C. 该装置为电解池,电流方向从A极沿导线经小灯泡流向B极
D. B 极接电池的正极,发生还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨气是一种重要的工业原料,可以制备如下图所示的一系列物质(部分产物未标出)
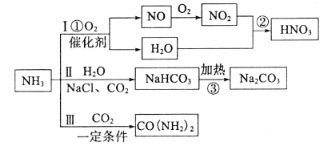
(1)线路Ⅰ为硝酸的制备
写出反应①的化学方程式________;反应②中氧化剂与还原剂的物质的量之比为_______,工业尾气中的氮氧化物常采用碱液法吸收,若NO与NO2按物质的量之比1:1被足量NaOH溶液完全吸收后只得到一种钠盐,该钠盐的化学式是_______。
(2)路线为Ⅱ纯碱的制备
写出反应③的化学方程式________,最终得到的纯碱中可能含有NaCl,检验是否存在NaCl的实验方案是________
(3)路线Ⅲ为尿素的制备
写出合成尿素的化学方程式________
(4)实验室中需要少量氨气,写出制备氨气的化学方程式________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有一混合物的水溶液,只可能含有以下离子中的若干种:K+、NH4+、Cl-、Mg2+、Ba2+、CO32-、SO42-,现取三份100mL该溶液进行如下实验:(已知:NH4++OH-![]() NH3↑+H2O)
NH3↑+H2O)
(1)第一份加入AgNO3溶液有沉淀产生;
(2)第二份加足量NaOH溶液加热后,收集到0.08mol气体;
(3)第三份加足量BaCl2溶液后,得干燥沉淀12.54g,经足量盐酸洗涤干燥后,沉淀质量为4.66g。根据上述实验,回答以下问题。
(1)由第一份进行的实验推断该混合物是否一定含有Cl-?________(答是或否)
(2)由第二份进行的实验得知混合物中应含有_____(填离子符号),其物质的量浓度为______。
(3)由第三份进行的实验可知12.54g沉淀的成分为________。
(4)综合上述实验,你认为以下结论正确的是_________。
A.该混合液中一定有K+、NH4+、CO32-、SO42-,可能含Cl-,且n(K)≥0.04mol
B.该混合液中一定有NH4+、CO32-、SO42-,可能含有K+、Cl-
C.该混合液中一定有NH4+、CO32-、SO42-,可能含有Mg2+、K+、Cl-
D.该混合液中一定有NH4+、SO42-,可能含有Mg2+、K+、Cl-
(5)我国政府为消除碘缺乏病,规定在食盐中必须加入适量的碘酸钾。检验食盐中是否加碘,可利用如下反应:KIO3+KI+H2SO4=K2SO4+I2+H2O
①配平该方程式,并且用单线桥法表示该方程式电子转移的方向和数目:________。
②该反应中氧化剂和还原剂的物质的量之比为_____________。
③如果反应中转移0.5mol电子,则生成I2的物质的量为_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com