
 (2)写出产生CO2的化学方程式C+2H2SO4(浓) $\frac{\underline{\;\;△\;\;}}{\;}$ CO2↑+2SO2↑+2H2O.
(2)写出产生CO2的化学方程式C+2H2SO4(浓) $\frac{\underline{\;\;△\;\;}}{\;}$ CO2↑+2SO2↑+2H2O.
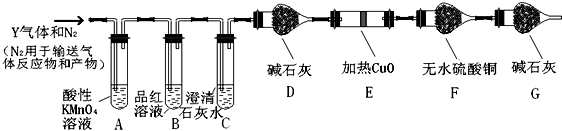
分析 (1)①Fe2+具有还原性,可与高锰酸钾发生氧化还原反应;
②根据反应的方程式SO2+Br2+2H2O=2HBr+H2SO4,H2SO4+BaCl2=BaSO4↓+2HCl,利用关系式法解答;
(2)碳能和浓硫酸反应生成二氧化硫、二氧化碳和水;
(3)二氧化硫和二氧化碳都能使澄清石灰水变浑浊,可用酸性高锰酸钾除去,为避免空气中水合二氧化碳进入F装置,G装置起到可吸收空气中的水和二氧化碳的作用;
(4)氢气具有还原性,能还原性,能还原黑色的氧化铜生成红色的铜单质,同时生成水,水能使无水硫酸铜变蓝色;
(5)确认气体Y中含有CO2,应完全排除二氧化硫的干扰,根据二氧化硫的漂白性解答;
(6)KMnO4溶液中导管末端做成球状多孔结构可以增大气体与溶液的接触,使气体充分被吸收.
解答 解:(1)①溶液为Fe3+和Fe2+离子的混合物,加入KSCN溶液和氯水、铁粉和KSCN溶液、浓氨水都不能检验亚铁离子的存在,亚铁离子具有还原性,高锰酸钾溶液呈紫色,具有氧化性,可与亚铁离子在酸性条件下反应二褪色,
故答案为:d;
②SO2+Br2+2H2O=2HBr+H2SO4,H2SO4+BaCl2=BaSO4↓+2HCl,所以硫酸钡和二氧化硫之间的关系式为SO2~BaSO4,
设二氧化硫的体积为V,
SO2-----BaSO4,
22.4L 233g
V 4.66g
V=0.448l=448mL,所以二氧化硫的体积分数=$\frac{448mL}{672mL}$×100%=66.7%,
故答案为:66.7%;
(2)碳素钢中含有碳,加热条件下,碳能和浓硫酸反应生成二氧化硫、二氧化碳和水,反应方程式为C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O,
故答案为:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O;
(3)二氧化硫和二氧化碳都能使澄清石灰水变浑浊,但二氧化硫具有还原性,可与酸性高锰酸钾发生氧化还原反应,反应的离子方程式为5SO2+2MnO4-+2H2O=5SO42-+2Mn2++4H+;
故答案为:除去混合气体中的SO2;5SO2+2MnO4-+2H2O=5SO42-+2Mn2++4H+;
(4)氢气具有还原性,能还原性,能还原黑色的氧化铜生成红色的铜单质,同时生成水,水能使无水硫酸铜变蓝色,这是检验水的特征反应,所以如果D中氧化铜变红,E中无水硫酸铜变蓝,则证明含有氢气,
故答案为:E中黑色固体变红色,F中无水硫酸铜由白色变蓝色;
(5)确认气体Y中含有CO2,应完全排除二氧化硫的干扰,当B中品红溶液不褪色,C中石灰水变浑浊,可说明含有CO2,
故答案为:B中品红溶液不褪色,C中石灰水变浑浊;
(6)KMnO4溶液中导管末端做成球状多孔结构可以增大气体与溶液的接触,使气体充分被吸收.
故答案为:增大接触面积,有利于SO2的充分吸收.
点评 本题考查了浓硫酸的性质、二氧化硫的性质、常见物质的检验等知识点,注意常温下,铁和冷的浓硫酸不是不反应,而是反应生成了致密的氧化物薄膜而阻止了进一步反应,为易错点,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | $\frac{{K}_{w}}{c({H}^{+})}$=0.1的溶液中:Na+、K+、SiO32-、SO32- | |
| B. | pH=1的溶液中:K+、Al3+、SO42-、F- | |
| C. | 与镁反应生成氢气的溶液中:Na+、Ba2+、NO3-、Cl- | |
| D. | 0.1mol/L的NaHCO3溶液中:NH4+、Mg2+、Br-、AlO2- |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 利用空气吹出SO2吸收法从海水中提溴时,直接将海水氯化,然后再进行吹出、吸收可得到溴产品 | |
| B. | 从海水中提取的重水可作原子能反应堆的中子减速剂和传热介质 | |
| C. | 盐田法制盐时,所用的盐田一般分成贮水池、蒸发池、结晶池三部分 | |
| D. | 利用电渗析法,冷冻法制盐,同时也可以得到淡水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{1}^{1}$H、${\;}_{1}^{2}$H、H+和H2是氢元素的四种不同粒子 | |
| B. | ${\;}_{20}^{40}$Ca和 ${\;}_{20}^{42}$Ca、石墨和金刚石均为同位素 | |
| C. | ${\;}_{1}^{1}$H和 ${\;}_{1}^{2}$H是不同的核素 | |
| D. | 12C和14C互为同位素,物理性质不同,但化学性质几乎完全相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
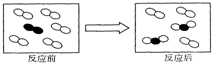
| A. | 反应前容器中的物质为单质 | |
| B. | 反应后容器中的物质为化合物 | |
| C. | 该反应为化合反应 | |
| D. | 该反应由两种反应物反应生成两种生成物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 化学键 | C-H | C-F | H-F | F-F |
| 键能/(kJ•mol-1) | 414 | 489 | 565 | 155 |
| A. | -1940 kJ•mol-1 | B. | 1940 kJ•mol-1 | C. | -485 kJ•mol-1 | D. | 485 kJ•mol-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com