
| A、HB-水解方程式:HB-+H2O?H3O++B2- | B、溶液中离子浓度大小为:c(Na+)=c(HB-)>c(OH-)=c(H+) | C、NaHB的存在抑制了水的电离 | D、相同物质的量浓度溶液的pH:Na2B>NaHB |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:



| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
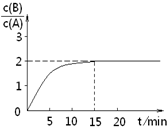 已知,某温度下在2L密闭容器中加入一定量A,发生以下化学反应:
已知,某温度下在2L密闭容器中加入一定量A,发生以下化学反应:| A、反应在前15min的平均速率ν(A)=0.11 mol?L-1?min-1 | B、A的初始物质的量为8 mol | C、反应到达平衡的过程中,放出的热量是77.2kJ | D、如使反应最终c(B)/c(A)=1.5,恒温恒容时,加入一定量的A可以实现 |
查看答案和解析>>
科目:高中化学 来源: 题型:
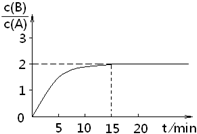 已知,某温度下在2L密闭容器中加入一定量A,发生以下化学反应:
已知,某温度下在2L密闭容器中加入一定量A,发生以下化学反应:| A、该温度下此反应平衡常数为3.2 | B、A的初始物质的量为4 mol | C、反应到达平衡的过程中,放出的热量是154.4kJ | D、如使反应最终c(B)/c(A)=3,只能降低反应温度 |
查看答案和解析>>
科目:高中化学 来源:2012-2013学年北京市房山区高三第二次模拟化学试卷(解析版) 题型:选择题
已知,某温度下在2L密闭容器中加入一定量A,发生以下化学反应:2A(g) 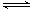 B(g)+C(g);ΔH =-48.25 kJ
· mol-1反应过程中时间t与A 、B浓度有下图所示关系,若测得第15min时c(B)=1.6 mol·L-1,则下列结论正确的是
B(g)+C(g);ΔH =-48.25 kJ
· mol-1反应过程中时间t与A 、B浓度有下图所示关系,若测得第15min时c(B)=1.6 mol·L-1,则下列结论正确的是

A.该温度下此反应平衡常数为3.2
B.A的初始物质的量为4 mol
C.反应到达平衡的过程中,放出的热量是154.4kJ
D.如使反应最终c(B)/c(A)=3,只能降低反应温度
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com