
【题目】常见有机反应类型有:①取代反应、②加成反应、③消去反应、④酯化反应、⑤加聚反应、⑥氧化反应、⑦还原反应,其中能在有机物中引入羟基的反应类型是
A. ①②③B. ①②⑦C. ⑤⑥⑦D. ③④⑥
 新题型全程检测期末冲刺100分系列答案
新题型全程检测期末冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】一定条件下反应2AB(g) ![]() A2(g)+B2(g)达到平衡状态的标志是
A2(g)+B2(g)达到平衡状态的标志是
A. 容器内压强不随时间变化B. 容器内,3种气体AB、A2、B2共存
C. 容器中各组分的体积分数不随时间变化D. AB的消耗速率等于A2的消耗速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】银锌电池是一种常见化学电源,其反应原理:Zn+Ag2O+H2O=Zn(OH)2+2Ag,其工作示意图如下。下列说法不正确的是
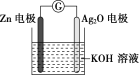
A.Zn电极是负极
B.Zn电极的电极反应式:Zn-2e-+2OH-=Zn(OH)2
C.Ag2O电极发生还原反应
D.放电前后电解质溶液的pH保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨气是一种用途广泛的化工原料。金属镓是一种广泛用于电子工业和通讯领域的重要金属,镓元素(31Ga)在元素周期表中位于第四周期IIIA族,化学性质与铝元素相似。
(1)下图是当反应器中按n(N2):n(H2)=1:3投料后,在200℃、400℃、600℃下,反应达到平衡时,混合物中NH3的物质的量分数随压强的变化曲线。
已知:N2(g)+3H2(g)![]() 2NH3(g) △H<0
2NH3(g) △H<0

①曲线c对应的温度是_____。
②关于工业合成氨的反应,下列叙述正确的是_____(填字母)。
A.及时分离出NH3可以提高H2的平衡转化率
B.根据勒夏特列原理,一般采用高温下发生反应
C.上图中M、N、Q点平衡常数K的大小关系是K(M)=K(Q)>K(N)
③工业上合成氨的催化剂为铁触媒,选择温度为500℃的原因是______。
(2)工业上利用Ga与NH3合成固体半导体材料氮化镓(GaN)同时有氢气生成。反应中,生成3molH2时就会放出30.8kJ的热量。
①该反应的热化学方程式是__________。
②该反应的化学平衡常数表达式是_____。
③在恒温恒容的密闭体系内进行上述可逆反应,下列有关表达正确的是_____。
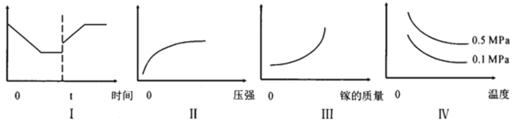
A.I图像中如果纵坐标为正反应速率,则t时刻改变的条件可以为升温
B.II图像中纵坐标可以为镓的转化率
C.III图像中纵坐标可以为化学反应速率
D.Ⅳ图像中纵坐标可以为体系内混合气体平均相对分子质量
④氮化镓(GaN)性质稳定,但能缓慢的溶解在热的NaOH溶液中,该反应的离子方程式是________。
(3)将一块镓铝合金完全溶于烧碱溶液中得到溶液X。己知:
Al(OH)3 | Ga(OH)3 | |
酸式电离常数Ka | 2×10-11 | 1×10-7 |
碱式电离常数Kb | 1.3×10-33 | 1.4×10-34 |
往X溶液中缓缓通入CO2,最先析出的氢氧化物是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中不正确的有
①除去乙烷中混有的乙烯可以将气体通过足量KMnO4溶液;
②超导陶瓷在某一临界温度下电阻为零,可用于电力、交通、医疗等领域;
③煤燃烧时加入适量石灰石,可减少废气中SO2的量;
④可以用加热氯化铵固体,再用碱石灰除去氯化氢的方法制氨气;
⑤高分子材料中的有机物分子均呈链状结构;
⑥除去粗盐溶液中的Ca2+、Mg2+和SO![]() ,可向溶液中依次加入过量BaCl2、NaOH、Na2CO3和HCl溶液,再过滤。
,可向溶液中依次加入过量BaCl2、NaOH、Na2CO3和HCl溶液,再过滤。
A.2个B.3个C.4个D.5个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组设计如图装置,验证黄铜矿(主要成分CuFeS2)在空气中的氧化产物(杂质不参与反应)。

回答下列问题。
(1)仪器a的名称______,碱石灰的作用______。
(2)为检验灼烧黄铜矿产生的气体,B中可选______
a.HNO3溶液b.品红溶液c.BaCl2溶液d.溴水e.酸性KMnO4溶液
(3)C中NaOH的作用______。
(4)样品经煅烧后的固体中铜元素以泡铜(Cu、Cu2O)形式存在,其中Cu2O能与稀硫酸反应生成Cu和CuSO4。
①设计实验验证泡铜中含有Cu2O:取少量泡铜置于试管中,________,若________,说明泡铜中含有Cu2O。
②用泡铜与CO反应来制取粗铜,再经精炼可得纯铜。将一定量的纯铜投入到2L1mol/L的稀硝酸中充分反应,请写出该反应的离子方程式_______。若铜全部溶解并得到标况下4.48LNO,要使溶液中的Cu2+恰好沉淀,需要向反应后的溶液中加入5mol/L的NaOH溶液____L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用AgNO3溶液分别滴定浓度均为0.0lmol/L的KCl、K2C2O4溶液,所得的沉淀溶解平衡图像如图所示(不考虑C2O42-的水解)。已知Ksp(AgC1)数量级为10-10。下列叙述不正确的是( )
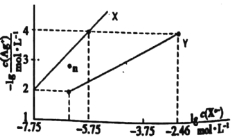
A.图中Y线代表的Ag2C2O4
B.n点表示AgCl的过饱和溶液
C.向c(Cl-)=c(C2O42-)的混合液中滴入AgNO3溶液时,先生成AgC1沉淀
D.Ag2C2O4+2Cl-=2AgC1+C2O42-的平衡常数为1.0×10-0.7l
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳及其化合物的用途广泛,碳元素不仅能形成丰富多彩的有机化合物,而且还能形成多种无机化合物,同时自身可以形成多种单质。
(1)C60分子形成的晶体中,在晶胞的顶点和面心均含有一个C60分子,则一个C60晶胞的质量为____。
(2)干冰和冰是两种常见的分子晶体,下列关于两种晶体的比较中正确的是____。
a. 晶体的密度:干冰>冰 b. 晶体的熔点:干冰>冰
c. 晶体中的空间利用率:干冰>冰 d. 晶体中分子间相互作用力类型相同
(3)金刚石和石墨是碳元素形成的两种常见单质,下列关于这两种单质的叙述中正确的有____。
a. 金刚石中碳原子的杂化类型为sp3杂化,石墨中碳原子的杂化类型为sp2杂化
b. 晶体中共价键的键长:金刚石中C-C<石墨中C-C
c. 晶体的熔点:金刚石>石墨
d. 晶体中共价键的键角:金刚石>石墨
e. 金刚石晶体中只存在共价键,石墨晶体中则存在共价键、金属键和范德华力
f. 金刚石和石墨的熔点都很高,所以金刚石和石墨都是原子晶体
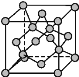
(4)金刚石晶胞结构如图所示,立方BN结构与金刚石相似,在BN晶体中,B原子周围最近的N原子所构成的立体图形为____,一个晶胞中N原子数目为____。
(5)碳与孔雀石共热可以得到金属铜,金属铜采用面心立方最密堆积,即在晶胞的顶点和面心均含有一个Cu原子,则Cu晶体中Cu原子的配位数为___。已知Cu晶体的密度为ρ g·cm-3,Cu的相对原子质量为M,阿伏加德罗常数为NA,则Cu的原子半径为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图所示是气体性质实验的常用装置,下列有关实验现象的说法不正确的是

A.若水槽中是水,试管中是NO2,可看到液面上升,若充入一定量的O2可使液体充满整个试管
B.若水槽中是NaOH溶液,试管中是Cl2,可看到液面上升、试管中黄绿色褪去
C.若水槽中是水并滴有几滴紫色石蕊,试管中是SO2,可看到液面上升并变为无色
D.若水槽中是水并滴有几滴酚酞,试管中是NH3,可看到液面上升并呈红色
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com