
【题目】下面是丁醇的两种同分异构体,其键线式、沸点如表所:
异丁醇 | 叔丁醇 | |
键线式 |
|
|
沸点/℃ | 108 | 82.3 |
下列说法不正确的是( )
A.异丁醇分子是由异丁基、羟基构成的
B.异丁醇的核磁共振氢谱有四组峰,且面积之比是![]()
C.表中沸点数据可以说明烃基结构会明显影响有机物的物理性质
D.异丁醇、叔丁醇在一定条件下经催化氧化可分别生成异丁醛、叔丁醛
科目:高中化学 来源: 题型:
【题目】实验室制取氯气的装置如图所示:

(1)实验原理:______________。
(2)实验装置:气体制备型化学实验装置的设计,要将化学反应原理、气体净化、收集和尾气处理等结合起来。
①填写装置中试剂名称,C______________,D____________,F__________。
②其中C的作用是除去氯气中的____________;D的作用是除去氯气中的____________。
③该装置中收集氯气使用的是________,还可用排__________的方法,原因是_____________。
④其中F的作用是_____________。
⑤检验氯气是否收集满可用__________放在集气瓶口,若试纸______,则证明已集满。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标况下将8.96 L氯化氢气体溶于水形成100 mL溶液,然后与足量的铁屑反应。
(1)所得盐酸溶液的物质的量浓度是多少________?
(2)参加反应的铁的质量是多少________?
(3)标况下生成氢气的体积是多少________?
(4)将生成的氯化亚铁配成400 mL溶液,此溶液中氯化亚铁的物质的量浓度是多少________?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水是巨大的资源宝库,从海水中提取食盐和溴的过程如下:

(1)请列举海水淡化的两种方法:________、________。
(2)步骤Ⅰ中已获得Br2,步骤Ⅱ中又将Br2还原为Br-,其目的是_________。
(3)步骤Ⅱ用SO2水溶液吸收Br2,吸收率可达95%,有关反应的离子方程式为_______,由此反应可知,除环境保护外,在工业生产中应解决的主要问题是_______。
(4)某化学研究性学习小组为了了解从工业溴中提纯溴的方法,查阅了有关资料知:Br2的沸点为59 ℃,微溶于水,有毒并有强腐蚀性。他们参观生产过程后,画了如下装置简图:

请你参与分析讨论:
①图中仪器B的名称是____________。
②整套实验装置中仪器连接均不能用橡胶塞和橡胶管,其原因是__________。
③实验装置气密性良好,要达到提纯溴的目的,操作中如何控制关键条件?___________。
④C中液体颜色为________________。为除去该产物中仍残留的少量Cl2,可向其中加入NaBr溶液,充分反应后,再进行的分离操作是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以电解食盐水为基础制取氯气等产品的工业称为“氯碱工业”,它是目前化学工业的重要支柱之一。
(1)若电解食盐水时消耗NaCl的质量为234 g,则在理论上最多可得氯气的体积为________升(标准状况)。
(2)若将2 mol的氯气通入足量石灰乳中,理论上可得到次氯酸钙________克。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究氢的获得和应用具有重要意义。
(1)已知:![]() 将0.20molH2S气体充入密闭容器中,保持恒压(p=a)、温度T1条件下进行上述反应。
将0.20molH2S气体充入密闭容器中,保持恒压(p=a)、温度T1条件下进行上述反应。
①下列可以作为反应达到平衡状态的判据是________。
A.气体的平均相对分子质量不变
B.![]()
C.K不变
D.容器体积不变
②![]() 时刻反应达到平衡,H2S的平衡转化率为40%。该反应的平衡常数Kp=________(用a的代数式表示。对于气相反应,用某组分B的平衡压强p(B)代替物质的量浓度c(B)也可表示平衡常数,记作Kp,如p(B)=p·x(B),p为平衡总压强,x(B)为平衡系统中B的物质的量分数)。
时刻反应达到平衡,H2S的平衡转化率为40%。该反应的平衡常数Kp=________(用a的代数式表示。对于气相反应,用某组分B的平衡压强p(B)代替物质的量浓度c(B)也可表示平衡常数,记作Kp,如p(B)=p·x(B),p为平衡总压强,x(B)为平衡系统中B的物质的量分数)。
③反应温度T1时,画出0~t2时段,n(S2)随时间变化曲线[n(S2)—t]。保持其它条件不变,改变反应温度为T2(T2>T1),画出0~t2时段,n(S2)随时间变化趋势的曲线[n(S2)—t]________

(2)已知:某催化剂作用下,H2还原NO的反应有两种可能:
Ⅰ.![]()
Ⅱ.![]()
反应历程可以表示为(![]() 表示吸附态)
表示吸附态)
吸附分解:![]() ①
①
![]() ②
②
反应脱附:![]() ③
③
![]() ④
④
![]() ⑤
⑤
其中,反应脱附过程中④与⑤是一组竞争关系,决定了H2还原NO的最终产物。
①如图显示不同温度条件下,原料气![]() ,达到平衡时体系中N2和N2O的含量,由此判断
,达到平衡时体系中N2和N2O的含量,由此判断![]() ________0(填“>”或“<”);判断反应脱附过程中④与⑤两步反应的活化能高低并说明理由________。
________0(填“>”或“<”);判断反应脱附过程中④与⑤两步反应的活化能高低并说明理由________。

②如图显示不同温度条件下,原料气![]() 分别为1、2、3(对应图中标注“1”、“2”、“3”),达到平衡时,体系中N2和N2O的含量,由此可知,增加H2的量,可以增加________的选择性(填“N2”或“N2O”)
分别为1、2、3(对应图中标注“1”、“2”、“3”),达到平衡时,体系中N2和N2O的含量,由此可知,增加H2的量,可以增加________的选择性(填“N2”或“N2O”)

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)比较元素非金属性的相对强弱:![]() ________
________![]() (填“>”、“<”或“=”);用一个化学方程式说明
(填“>”、“<”或“=”);用一个化学方程式说明![]() 与
与![]() 氧化性的相对强弱________。
氧化性的相对强弱________。
(2)离子化合物![]() 可被用于治疗消化道疾病,各原子均满足8电子稳定结构。写出
可被用于治疗消化道疾病,各原子均满足8电子稳定结构。写出![]() 的电子式________。
的电子式________。
(3)半导体材料单晶硅的熔点高、硬度大,主要原因是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将煤直接作为燃料燃烧,不但热效率较低,且产生烟尘、二氧化硫、氮的氧化物等,带来严重的环境污染。煤干馏是提高煤利用率、生产重要化工原料、降低污染物排放量的有效措施之一。
某化学学习小组在实验室条件下探究煤干馏的现象及产物,装置如下,请回答有关问题:
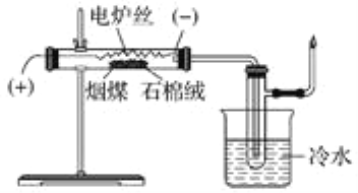
(1)煤干馏的条件是________________________________________________________
(2)盛有冷水的烧杯的作用是________________________________________________。
(3)实验后检验生成粗氨水的操作是_________________________________________。
(4)已知一氧化碳不能使溴水褪色,若将具支试管出来的气体通入溴水中,发现溴水褪色,则说明产生了_____________________________________________________________。
(5)检验具支试管出来的气体的性质后,将尾气点燃,火焰的颜色为______________。
(6)从煤焦油中分离出苯及其同系物的实验方法是_________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组设计了一组实验来探究元素周期律。
甲同学根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图1装置来一次性完成同主族元素非金属性强弱比较的实验研究;
乙同学设计了如图2装置来验证卤族元素性质的递变规律,A、B、C三处分别是蘸有溴化钠溶液的棉花、湿润的淀粉碘化钾试纸、湿润的红色纸条。
已知常温下浓盐酸与高锰酸钾能反应生成氯气;
可选择的试剂有:大理石、碳酸钠粉末、浓盐酸、稀硝酸、硅酸钠溶液。
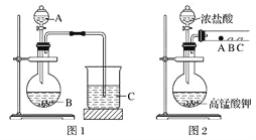
(1)甲同学实验中(图1):
①从给出试剂中选出最佳物质(填化学式):A________,B________。
②烧杯C中发生反应的离子方程式为__________________________。
(2)乙同学实验中(图2):
①写出A处反应的离子方程式________________________。
②B处实验现象是________________________。
③若高锰酸钾的还原产物为Mn2+,当有0.04 mol高锰酸钾参加反应时,则可生成标准状况下的氯气的体积为______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com