
| A. | $\frac{a}{22.4}$摩/升 | B. | $\frac{ab}{22400}$摩/升 | ||
| C. | $\frac{ab}{22400+36.5a}$摩/升 | D. | $\frac{1000ab}{22400+36.5a}$摩/升 |
分析 先根据n=$\frac{V}{{V}_{m}}$计算出标准状况下aL氯化氢的物质的量,然后根据m=nM计算出氯化氢的质量,1L水的质量约为1000g,从而可知溶液质量,再根据V=$\frac{m}{ρ}$计算出所得溶液体积,最后根据c=$\frac{n}{V}$计算出该盐酸的物质的量浓度.
解答 解:标准状况下的a L 氯化氢气体的物质的量为:n(HCl)=$\frac{aL}{22.4L/mol}$=$\frac{a}{22.4}$mol,该HCl的质量为:36.5g/mol×$\frac{a}{22.4}$mol=$\frac{36.5a}{22.4}$g,
1L水的质量约为1000g,则该盐酸质量为:1000g+$\frac{36.5a}{22.4}$g,
该盐酸的体积为:$\frac{1000g+\frac{36.5a}{22.4}g}{bg/mL}$=$\frac{22400+36.5}{22.4b}$mL,
所以该盐酸的物质的量浓度为:c(HCl)=$\frac{\frac{a}{22.4}mol}{\frac{22400+36.5a}{22.4b}×1{0}^{-3}L}$=$\frac{1000ab}{22400+36.5a}$mol/L,
故选D.
点评 本题考查了物质的量浓度的计算,题目难度不大,正确计算溶液体积为解答关键,注意掌握物质的量浓度的概念及表达式,试题培养了学生的分析能力及化学计算能力.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:推断题
 ,最高价氧化物的化学式为:Cl2O7.
,最高价氧化物的化学式为:Cl2O7. .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
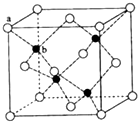 E、G、M、Q、T是五种原子序数依次增大的前四周期元素,E、G、M是位于P区的同一周期的元素,M的价层电子排布为Nsnnp2n,E与M原子核外的未成对电子数相等;QM2与GM2-为等电子体;T为过渡元素,其原子核外没有未成对电子.请回答下列问题:
E、G、M、Q、T是五种原子序数依次增大的前四周期元素,E、G、M是位于P区的同一周期的元素,M的价层电子排布为Nsnnp2n,E与M原子核外的未成对电子数相等;QM2与GM2-为等电子体;T为过渡元素,其原子核外没有未成对电子.请回答下列问题: .E、M电负性相差1.0,由此可以判断EM应该为极性较强的分子,但实际上EM分子的极性极弱,请解释其原因从电负性分析,CO中的共用电子对偏向氧原子,但分子中形成配位键的电子对是由氧原子单方面提供的,抵消了共用电子对偏向O而产生的极性.
.E、M电负性相差1.0,由此可以判断EM应该为极性较强的分子,但实际上EM分子的极性极弱,请解释其原因从电负性分析,CO中的共用电子对偏向氧原子,但分子中形成配位键的电子对是由氧原子单方面提供的,抵消了共用电子对偏向O而产生的极性.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径由大到小的顺序:W、Y、Z、X | |
| B. | 简单气态氢化物的稳定性由强到弱的顺序:Y、Z、W | |
| C. | 在化合物Y2X2、Z2X4分子中含有的共用电子对数相等 | |
| D. | 在元素W、Y、Z中,最高价氧化物的水化物酸性最强的是W |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题

| A. | W点所示的溶液:c(Na+)>c(CO32-)=c(HCO3-)>c(OH-)>c(H+) | |
| B. | pH=4的溶液:c(H2CO3)+c(HCO3-)+c(CO32-)=0.1 mol•L-1 | |
| C. | 向pH=8的溶液中通入CO2至pH=7所得的溶液:c(Na+)>c(Cl-)+c(HCO3-)+c(H2CO3) | |
| D. | pH=11的溶液:c(Na+)+2c(H2CO3)>2c(Cl-)+2c(CO32-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
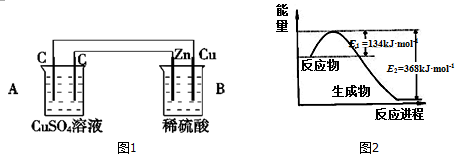
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
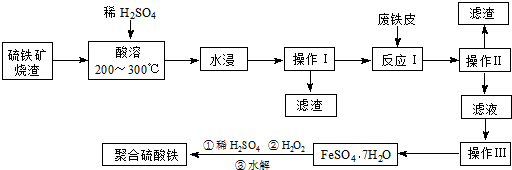
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com