
【题目】下列关于化学平衡状态的说法中正确的是( )
A. 改变外界条件不能改变化学平衡状态
B. 当某反应在一定条件下反应物转化率保持不变时即达到了化学平衡状态
C. 当某反应体系中气体的压强不再改变时,该反应一定达到平衡状态
D. 当某反应达到平衡状态时,反应物和生成物的浓度一定相等
科目:高中化学 来源: 题型:
【题目】某研究性学习小组学生根据氧化还原反应规律,探究NO2、NO与Na2O2反应的情况,提出假设并进行相关实验。
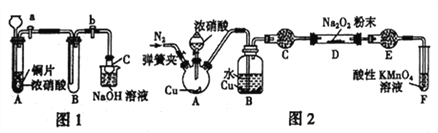
Ⅰ.从理论上分析Na2O2和NO2都既有氧化性又有还原性,于是提出如下假设:
假设1:Na2O2氧化NO2;假设2:NO2 氧化Na2O2。
(1)甲同学设计如图1装置进行实验:
①试管A 中反应的离子方程式是____________________________。
②待试管B 中充满红棕色气体,关闭旋塞a和b;取下试管B;向其中加入适量Na2O2粉末,塞上塞子,轻轻振荡试管内粉末,观察到红棕色气体迅速消失;再将带火星的木条迅速伸进试管内,木条复燃。
③仪器C兼有防倒吸的作用,仪器C的名称为___________________。
结论:甲同学认为假设2 正确。
(2)乙同学认为甲同学设计的实验存在缺陷,为达到实验目的,在A、B之间应增加一个装置,该装置的作用是________________________。乙同学用改进后的装置,重复了甲同学的实验操作,观察到红棕色气体迅速消失;带火星的木条未复燃,得出结论:假设1正确,则NO2和Na2O2反应的化学方程式是_______________________。
Ⅱ.该研究性学习小组同学还认为NO 易与O2发生反应,应该更易被Na2O2氧化。查阅资料:2NO+Na2O2=2NaNO2;2NaNO2+2HCl=2NaCl+NO2↑+NO↑+H2O; 酸性条件下,NO 能与MnO4-反应生成NO3-和Mn2+。
(3)丙同学用图2所示装置(部分夹持装置略)探究NO与Na2O2的反应。
①在反应前,打开弹簧夹,通入一段时间N2,目的是_________________。
②B 中观察到的主要现象是____________(填字母编号)。
a.铜片逐渐溶解,溶液变为蓝色 b.有红棕色气泡产生 C.有无色气泡产生③C、E 中所盛装的试剂不能是________(填字母编号)。
a.无水硫酸铜 b.无水氯化钙 c.碱石灰 d.生石灰
④F 中发生反应的氧化剂与还原剂的物质的量之比为_____________。
⑤充分反应后,检验D装置中产物的方法是:______________ ,则产物是NaNO2。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图装置放置一段时间后,铁钉均被腐蚀。下列有关描述不正确的是( )
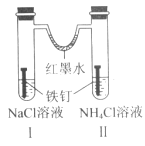
A.红墨水水柱两边的液面变为左低右高
B.I 和Ⅱ中负极反应式均为 Fe-2e-=Fe2+
C.I 中正极反应式为 O2+2H2O+4e-=4OH
D.Ⅱ中 NH4Cl 溶液里有气泡产生
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下,由CO和CO2组成的混合气体13.44L,质量为20g。
求:(1)此混合气体中CO和CO2的物质的量各为多少?___________________
(2)混合气体缓慢通过足量的澄清石灰水后,剩余的气体是什么?其质量为多少?其所含电子数为多少?________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①298 K时K(HF)=3.5×10-4,Ksp(CaF2)=1.8×10-7
②HF(aq)![]() H+(aq)+F-(aq) ΔH<0
H+(aq)+F-(aq) ΔH<0
根据以上已知信息判断下列说法正确的是( )
A. 298 K时,加蒸馏水稀释HF溶液,![]() 保持不变
保持不变
B. 308 K时,HF的电离常数Ka>3.5×10-4
C. 298 K时,向饱和CaF2溶液中加入少量CaCl2,Ksp(CaF2)会减小
D. 2HF(aq)+Ca2+(aq)![]() CaF2(s)+2H+(aq) K≈0.68
CaF2(s)+2H+(aq) K≈0.68
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】10mLNO、CO2的混合气体通过足量的Na2O2后,气体的体积变为5mL(相同状况),则CO2和NO的体积比不可能为
A. 1∶1 B. 1∶2
C. 2∶1 D. 3∶2
【答案】B
【解析】
NO、CO2的混合气体通过足量的Na2O2发生反应有2Na2O2+2CO2═2Na2CO3+O2、2NO+O2═2NO2,问题的关键在于NO与氧气反应存在着三种可能性,一种情况是恰好反应,一种情况是NO过量,另一种情况可能是O2过量,据此讨论计算。
NO、CO2的混合气体通过足量的Na2O2发生反应有(1)2Na2O2+2CO2═2Na2CO3+O2、(2)2NO+O2═2NO2,假设参加反应的CO2为x mL,NO为ymL,则x+y=10,由方程式得以下关系:
①2CO2+ 2Na2O2= 2Na2CO3+ O2
2mL 1mL
xmL ![]() mL
mL
②2NO + O2 = 2NO2
2mL 1mL 2mL
ymL ![]() mL
mL
当反应②恰好反应时,即当y=x时(此时x、y都等于5),生成的NO2的体积为5mL,显然符合题意,A正确;当y>x时,NO有过量,O2反应完,此时反应掉的NO为xmL,则剩余的NO为(ymL-xmL),生成的NO2气体为xmL,因此反应最后得到的混合气体为NO和NO2,其体积和为(ymL-xmL)+xmL=ymL,结合x+y=10,再根据NO过量的前提条件为y>x,可以得出结论y>5,这与题意“气体体积缩小为5mL”不符,B错误;当y<x时,NO不足,O2过量,此时反应掉的O2为![]() mL,剩余的O2为(
mL,剩余的O2为(![]() —
—![]() )mL,生成的NO2气体为ymL,因此,反应最后得到的混合气体为O2和NO2,其体积和为:(
)mL,生成的NO2气体为ymL,因此,反应最后得到的混合气体为O2和NO2,其体积和为:(![]() —
—![]() )mL+ymL=5mL,这与题意“气体体积缩小为5mL”符合,这表明如果y<x,这种情况都能符合题意,C、D正确,故选B。
)mL+ymL=5mL,这与题意“气体体积缩小为5mL”符合,这表明如果y<x,这种情况都能符合题意,C、D正确,故选B。
【点睛】
本题考查混合物的有关计算,属于讨论型计算,侧重对综合能力的考查,确定反应可能的情况是解答的关键。
【题型】单选题
【结束】
24
【题目】在一定温度和压强下,将一支容积为21mL的试管充满NO2后,倒置于一个盛水的水槽中,当试管内液面上升一定高度不再变化时,在相同条件下再通入O2,若要使试管内的液面仍保持在原高度,则通入O2的体积为
A. 8.75mL B. 12.25mL
C. 5.25mL D. 10.5mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝和氢氧化钾都是重要的工业产品。请回答:
(1)铝与氢氧化钾溶液反应的离子方程式是______________________________。
(2)用铝粉和Fe2O3做铝热反应实验,需要的试剂还有____________(填序号)。
a.KCl b.KClO3 c.MnO2 d.Mg
取少量铝热反应所得到的固体混合物,将其溶于足量稀H2SO4,滴加KSCN溶液无明显现象,________(填“能”或“不能”)说明固体混合物中无Fe2O3,理由是(用离子方程式说明)___________。
(3)工业级氢氧化钾的溶液中含有某些含氧酸根杂质,可用离子交换膜法电解提纯。电解槽内装有阳离子交换膜(只允许阳离子通过),其工作原理如下图所示。
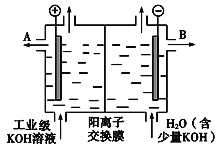
①该电解槽的阳极反应式是_______________________________。
②通电开始后,阴极附近溶液pH会增大,请简述原因____________________________。
③除去杂质后的氢氧化钾溶液从液体出口______(填写“A”或“B”)导出。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“化学是五颜六色的”是指在化学实验中有着丰富多彩的颜色变化。下列有关反应获得的颜色不正确的是( )
①红 ②橙 ③黄 ④绿 ⑤青 ⑥蓝 ⑦紫
A.乙烯气体通入酸性高锰酸钾溶液中:⑦
B.淀粉遇碘:⑥
C.蛋白质遇浓硝酸:③
D.热的氧化铜遇酒精:①
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com