
【化学一一选修物质结构与性质】(15分)
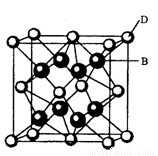
有A、B、C、D、E、F六种元素,A是周期表中原子半径最小的元素,B是电负性最大的元素,C的2p轨道中有三个未成对的单电子,F原子核外电子数是B与C核外电子数之和,D是主族元素且与E同周期,E能形成红色(或砖红色)的E2O和黑色的EO两种氧化物, D与B可形成离子化合物其晶胞结构如图所示。
请回答下列问题。
(1)E元素原子基态时的价电子排布式为 ;
(2)A2F分子中F原子的杂化类型是 ;
(3)C元素与氧形成的离子CO2-的立体构型是__________;写出一种与CO2-互为等电子体的分子的分子式________;
(4)将E单质的粉末加入CA3的浓溶液中,通入O2,充分反应后溶液呈深蓝色,该反应的离子方程式是______________________________________________________;
(5)从图中可以看出,D跟B形成的离子化合物的化学式为 ;若离子化合物晶体的密度为ag·cm-3,则晶胞的体积是 (写出表达式即可)。
(1)3d104s1(2分) (2)sp3 (2分) (3)V形(2分) O3或SO2(2分)
(4)2Cu+8NH3·H2O+O2=2[Cu(NH3)4]2++4OH-+6H2O(2分)
(5)CaF2(2分) (3分)
(3分)
【解析】
试题分析:有A、B、C、D、E、F六种元素,A是周期表中原子半径最小的元素,则A是氢元素。B是电负性最大的元素,则B是氟元素。C的2p轨道中有三个未成对的单电子,则C的核外电子排布为1s22s22p3,即C是氮元素。F原子核外电子数是B与C核外电子数之和,则F的核外电子数是16,即F是硫元素。D是主族元素且与E同周期,E能形成红色(或砖红色)的E2O和黑色的EO两种氧化物,这说明E是铜。D与氟元素可形成离子化合物其晶胞结构如右图所示,根据晶胞结构可知晶胞中含有8个F原子,含有D原子的个数是8×1/8+6×1/2=4,即化学式为DF2,所以D是Ca元素。
(1)E元素的原子序数是29,则根据核外电子排布规律可知E元素原子基态时的价电子排布式为3d104s1;
(2)A2F分子是H2S,分子中S原子含有2对孤对电子,其杂化类型是sp3杂化;
(3)N元素与氧形成的离子NO2-中氮元素价层电子对数=2+(5+1-2×2)÷2=3,因此立体构型是V形;价电子数和原子数分别都相等的互为等电子体,则与CO2-互为等电子体的分子的分子式O3或SO2;
(4)将铜单质的粉末加入氨气的浓溶液中,通入O2,充分反应后溶液呈深蓝色,生成络合物,则该反应的离子方程式是2Cu+8NH3·H2O+O2=2[Cu(NH3)4]2++4OH-+6H2O;
(5)根据以上分析可知D跟B形成的离子化合物的化学式为CaF2;若离子化合物晶体的密度为ag·cm-3,则 ,所以晶胞的体积是
,所以晶胞的体积是 。
。
考点:考查物质与结构性质的分析和判断


科目:高中化学 来源:2014-2015广东省高二上学期期中联考化学(理)试卷(解析版) 题型:选择题
某气态烃0.5 mol能与1 mol HCl完全加成,加成后产物分子上的氢原子又可与4 mol Cl2发生取代反应,则此气态烃可能是
A.CH2===CH—CH3 B.CH2===CH2
C.CH2===CH—CH===CH2 D.CH2===C(CH3)2
查看答案和解析>>
科目:高中化学 来源:2014-2015学年安徽省江南十校高三上学期期末联考理综化学试卷(解析版) 题型:选择题
芥子气[(ClCH2CH2)2S是一种毒气,即使嗅觉不能感受的极低浓度也会对人造成伤害,可用NaOH溶液解毒。芥子气可用以下方法制备 2CH2=CH2+S2Cl2→(ClCH2CH2)2S+S下列有关说法正确的是
A.芥子气是直线型分子 B.S2Cl2中有极性键和非极性键
C.制备反应中S2Cl2,作还原剂 D.NaOH溶液解毒原理是中和反应
查看答案和解析>>
科目:高中化学 来源:2014-2015学年黑龙江省哈尔滨市高三上学期期末考试化学试卷(解析版) 题型:选择题
俗话说“雷雨发庄稼”这是因为雷雨天空气中的某些物质之间发生了一系列化学反应,最终产生了氮肥。下列不属于其中的反应的是
A.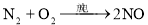
B.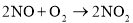
C.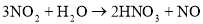
D.
查看答案和解析>>
科目:高中化学 来源:2014-2015学年黑龙江省哈尔滨市高三上学期期末考试化学试卷(解析版) 题型:选择题
下列互为同位素的是
A.613C和C60 B.白磷和红磷 C.乙醇和甲醚 D.11H和12H
查看答案和解析>>
科目:高中化学 来源:2015年湖北省荆门市高三元月调考理综化学试卷(解析版) 题型:选择题
工业上制备纯硅反应的热化学方程式如下:SiCl4(g)+2H2(g) Si(s)+4HCl(g) △H= Q kJ/mol (Q>0)某温度、压强下,将一定量反应物通入密闭容器进行以上反应,下列叙述正确的是
Si(s)+4HCl(g) △H= Q kJ/mol (Q>0)某温度、压强下,将一定量反应物通入密闭容器进行以上反应,下列叙述正确的是
A.反应过程中,若增大压强能提高SiCl4的转化率
B.若反应开始时SiCl4为1 mol, 则达平衡时,吸收热量为Q kJ
C.反应至4 min时,若HCl浓度为0.12 mol/L,则H2的反应速率为0.03 mol/(L·min)
D.当反应吸收热量为0.025Q kJ时,生成的HCl通入100 mL 1 mol/L的NaOH溶液恰好反应
查看答案和解析>>
科目:高中化学 来源:2014-2015学年重庆市七校高三上学期期末联考理综化学试卷 (解析版) 题型:填空题
(共16分)
Ⅰ.(10分)已知2A(g)+B(g)  2C(g);△H=-a kJ/mol(a>0),在一个有催化剂的固定容积的容器中加入2molA和1molB,在500℃时充分反应达平衡后C的浓度为w mol/L,放出热量b kJ。
2C(g);△H=-a kJ/mol(a>0),在一个有催化剂的固定容积的容器中加入2molA和1molB,在500℃时充分反应达平衡后C的浓度为w mol/L,放出热量b kJ。
(1)比较a b( 填 > 、 = 、 < )
(2)若在原来的容器中,只加入2mol C,500℃时充分反应达平衡后,吸收热量ckJ,C物质的浓度 (填>、=、<)w mol/L,a、b、c之间满足的关系式为 (用含a、b、c的代数式表示)。
(3)能说明该反应已经达到平衡状态的是 。
a、V(C)=2V(B); b、容器内压强保持不变
c、V逆(A)=2V正(B) d、容器内的密度保持不变
(4)若将上述容器改为恒压容器(反应前体积相同),起始时加入2molA和lmolB,500℃时充分反应达平衡后,放出热量d kJ,则d b ( 填 > 、 = 、 < ),
Ⅱ.(6分)用吸收H2后的稀土储氢合金作为电池负极材料(用MH表示),
NiO(OH)作为电池正极材料,KOH溶液作为电解质溶液,可制得高容量,长寿命的镍氢电池。电池充放电时的总反应为:
NiO(OH)+MH Ni(OH)2+M
Ni(OH)2+M
(1)电池放电时,负极的电极反应式为_______
(2)充电完成时,Ni(OH)2全部转化为NiO(OH)。若继续充电将在一个电极产生O2,O2扩散到另一个电极发生电极反应被消耗,从而避免产生的气体引起电池爆炸,此时,阴极的电极反应式为________。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省协作体高三上学期第二次月考化学试卷(解析版) 题型:选择题
氯酸是一种强酸,浓度超过40%时会发生分解,反应可表示为:a HClO3 = bO2↑+ cCl2↑+ dHClO4 + eH2O用湿润的淀粉碘化钾试纸检验气体产物时,试纸先变蓝后褪色。下列说法正确的是
A.由反应可确定:氧化性HClO4>HClO3
B.若化学计量数a=8,b=3,则该反应转移电子数为20e-
C.变蓝的淀粉碘化钾试纸褪色是因为可能发生了:4C12 + I2 + 6H2O = 12H+ + 8Cl-+ 2IO3-
D.若氯酸分解所得混合气体,lmol混合气体质量为47.6g,则反应方程式可表示为:26HClO3 = 15O2↑+ 8C12↑+ 10HClO4 + 8H2O
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省杭州地区7校高三上学期期末模拟联考化学试卷(解析版) 题型:选择题
下列图示与对应的叙述相符的是

A.图甲表示向CH3COOH溶液中逐步加入CH3COONa固体后,溶液pH的变化
B.图乙表示向醋酸溶液中加水时其导电性变化,则CH3COOH溶液的pH:a>b
C.图丙表示催化剂能改变化学反应的焓变
D.图丁表示等量NO2在容积相同的恒容密闭容器中,不同温度下分别发生反应:2NO2 (g) N2O4(g),相同时间后测得NO2含量的曲线,则该反应的△H<0
N2O4(g),相同时间后测得NO2含量的曲线,则该反应的△H<0
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com