
| A. | C和Mg | B. | Si和Na | C. | Cl和C | D. | B和He |
分析 根据题意和电子排布规律L层最多排布8个电子,确定A、B的电子层数和各层排布的电子数.
解答 解:根据题意,B原子的L层电子数恰为A原子L层电子数的2倍,而L层最多排布8个电子,因此,B的L层有8个电子,而A的L层有4个电子(无M层),根据“A原子的M层比B原子的M层少2个电子”可知,B的M层上有2个电子,即A共有K、L电子层,排布的电子数分别为2、4,B共有K、L、M电子层,排布的电子数分别为2、8、2,故A是C,B是Mg,
故选A.
点评 本题要根据题目电子层和电子数的关系,逐步确定A、B的电子层数和各层上的电子数,有些同学思维混乱,原因是没理清题目中的信息,不能结合电子排布规律分析,因此要把排布规律与题意结合起来,整体把握.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 Fenton法常用于处理含难降解有机物的工业废水,通常是在调节好pH和Fe2+浓度的废水中加入H2O2,所产生的羟基自由基能氧化降解污染物.现运用该方法降解有机污染物p-CP,探究有关因素对该降解反应速率的影响.
Fenton法常用于处理含难降解有机物的工业废水,通常是在调节好pH和Fe2+浓度的废水中加入H2O2,所产生的羟基自由基能氧化降解污染物.现运用该方法降解有机污染物p-CP,探究有关因素对该降解反应速率的影响.| 实验编号 | 实验目的 | T/K | pH | c/10-3 mol•L-1 | |
| H2O2 | Fe2+ | ||||
| ① | 为以下实验作参照 | 298 | 3 | 6.0 | 0.30 |
| ② | 探究温度对降解反应速率的影响 | 3 | |||
| ③ | 298 | 10 | 6.0 | 0.30 | |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某同学分析Zn与稀H2SO4的反应.
某同学分析Zn与稀H2SO4的反应.| 1分钟水滴数(断开K) | 34 | 59 | 86 | 117 | … | 102 |
| 1分钟水滴数(闭合K) | 58 | 81 | 112 | 139 | … | 78 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 晶体中只要有阳离子就一定有阴离子 | |
| B. | 氢键属于分子间作用力,不存在于分子内 | |
| C. | 原子晶体的熔点一定比金属晶体的高 | |
| D. | 构成分子晶体的微粒不一定含有共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 三种 | B. | 四种 | C. | 五种 | D. | 六种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
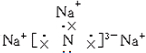 ,该化合物由离子键形成.
,该化合物由离子键形成. ,
, .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | E | F | ||||||
| 3 | A | C | D | G | R | |||
| 4 | B | H |
 ;G、H 氢化物的稳定性递减的顺序是HCl>HBr.
;G、H 氢化物的稳定性递减的顺序是HCl>HBr. ;.
;. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com