
已知A、B、C、D、E、F都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E<F。其中A原子核外有三个未成对电子;化合物B2E的晶体为离子晶体,E原子核外的M层中只有两个成对电子;C元素是地壳中含量最高的金属元素;D单质的晶体类型在同周期的单质中没有相同的;F原子核外最外层电子数与B相同,其余各层电子均充满。
请根据以上信息,回答下列问题(答题时,A、B、C、D、E、F用所对应的元素符号表示):
(1)A、B、C、D的第一电离能由小到大的顺序为______________________。
(2)B的氯化物的熔点比D的氯化物的熔点________(填“高”或“低”),理由是
________________________________________________________________________
________________________________________________________________________。
(3)F的核外电子排布式是______________________________,F的高价离子与A的简单氢化物形成的配离子的化学式为__________。
(4)A、F形成某种化合物的晶胞结构如下图所示(其中A显-3价),则其化学式为
____________。(每个球均表示1个原子)
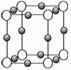
(5)A、C形成的化合物具有高沸点和高硬度,是一种新型无机非金属材料,则其化学式为____________________,其晶体中所含的化学键类型为________________,其晶体类型是____________。
科目:高中化学 来源: 题型:
2008年9月25日,“神舟”七号太空飞船被“长征2号”F型火箭送入太空。“神舟”七号太空飞船的外壳是一种新型结构陶瓷材料,它的主要成分是氮化硅。氮化硅是一种高温陶瓷材料,它的硬度大、熔点高、化学性质稳定。
(1)氮化硅晶体属于________晶体。
(2)下列物质融化时,所克服的微粒间作用力与氮化硅熔化时所克服的微粒间作用力相同的是________。
①单质I2和金刚石 ②晶体硅和二氧化硅
③冰和干冰 ④金刚石和碳化硅
(3)已知氮化硅的晶体结构中,原子间都以单键相连,且氮原子与氮原子、硅原子与硅原子不直接相连,同时每个原子都满足8电子稳定结构,请写出氮化硅的化学式:________。
(4)现用四氯化硅和氮气在氢气气氛保护下,加强热发生反应,可得到较高纯度的氮化硅,反应的化学方程式为______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列性质适合于离子晶体的是( )
A.熔点1 070℃,易溶于水,水溶液能导电
B.熔点10.31℃,液态不导电,水溶液能导电
C.能溶于CS2,熔点112.8℃,沸点444.6℃
D.熔点97.81℃,质软,导电,密度0.97 g·cm-3
查看答案和解析>>
科目:高中化学 来源: 题型:
参考表中物质的熔点,回答有关问题。
| 物质 | NaF | NaCl | NaBr | NaI | NaCl | KCl | RbCl | CsCl |
| 熔点/℃ | 995 | 801 | 755 | 651 | 801 | 776 | 715 | 646 |
| 物质 | SiF4 | SiCl4 | SiBr4 | SiI4 | SiCl4 | GeCl4 | SnCl4 | PbCl4 |
| 熔点/℃ | -90.2 | -70.4 | 5.2 | 120.0 | -70.4 | -49.5 | -36.2 | -15.0 |
(1)钠的卤化物及碱金属的氯化物的熔点与卤离子及碱金属离子的__________有关,随着__________的增大,熔点依次降低。
(2)硅的卤化物及硅、锗、锡、铅的氯化物的熔点与________________有关,随着________________增大,________________增大,故熔点依次升高。
(3)钠的卤化物的熔点比相应的硅的卤化物的熔点高得多,这与__________有关,因为一般__________比__________的熔点高。
查看答案和解析>>
科目:高中化学 来源: 题型:
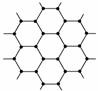
石墨晶体是层状结构(如右图),在每一层内,每一个碳原子都跟其他3个碳原子相结合,据图分析,石墨晶体中碳原子数和共价键数之比为( )
A.2∶3 B.2∶1
C.1∶3 D.3∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
物质结构理论推出:金属晶体中金属阳离子与自由电子之间的强烈的相互作用,叫金属键。金属键越强,其金属的硬度越大,熔、沸点越高,且据研究表明,一般说来金属原子半径越小,价电子数越多,则金属键越强。由此判断下列说法错误的是( )
A.镁的硬度小于铝
B.镁的熔、沸点低于钙
C.镁的硬度大于钾
D.钙的熔、沸点高于钾
查看答案和解析>>
科目:高中化学 来源: 题型:
现有甲、乙、丙三种晶胞,如图所示。
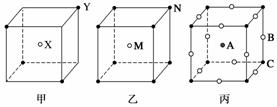
甲中X处于晶胞中心;乙中M处于晶胞中心;丙中A处于晶胞中心,B处于棱上,C处于顶点。由此可知:
(1)甲晶胞中X与Y的个数之比为________________________________________。
(2)乙晶胞中M与N的个数之比为________________________________________。
(3)丙的化学式是_______________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
苯分子不能使酸性KMnO4溶液褪色的原因是( )
A.分子中不存在π键
B.分子中存在6电子大π键,结构稳定
C.分子是平面结构
D.分子中只存在σ键
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com