
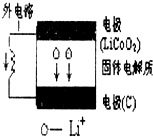
| A. | 电池内部“→”表示放电时Li+的迁移方向,外电路上的“→”表示放电时的电流方向 | |
| B. | 放电时负极的电极反应:LiCoO2-xe-═Li1-xCoO2+xLi+ | |
| C. | 充电时阴极的电极反应:6C+xLi++xe-═LixC6 | |
| D. | 当外电路有2 mole-通过,发生迁移的Li+的质量为7 g(Li的相对原子质量为 7) |
分析 根据电池内部锂离子移动方向知,C作正极,LiCoO2为负极,
A.电子从负极沿导线流向正极;
B.放电时,负极上失电子发生氧化反应;
C.充电时,阴极上得电子发生还原反应;
D.根据电子与Li+的关系分析.
解答 解:A.根据电池内部锂离子移动方向知,C是原电池正极,LiCoO2为负极,电子从LiCoO2沿导线流向正极C,则外电路上的“→”表示放电时的电子方向,故A错误;
B.放电时负极上失电子发生氧化反应,电极反应式为LiCoO2-xe-=Li1-xCoO2+xLi+,故B正确;
C.充电时,阴极上得电子发生还原反应,电极反应式为Li1-xCoO2+xLi++xe-=LiCoO2,故C错误;
D.当外电路有2 mole-通过,发生迁移的Li+的物质的量为2mol,其质量为14 g,故D错误;
故选B.
点评 本题考查了化学电源新型电池,正确理解题意是解本题关键,根据锂离子移动方向确定正负极,再结合电池反应式中元素化合价变化来分析解答,难点是电极反应式的书写,难度中等.


 互动英语系列答案
互动英语系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 混合物:空气、矿泉水、水银 | B. | 碱:Ba(OH)2、Cu2(OH)2CO3、NH3•H2O | ||
| C. | 氧化物:H2O、CO、HCOOH | D. | 盐:苏打 醋酸钠、氯化铵 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若反应A(s)=B(s);△H<O,则说明A物质比B物质稳定 | |
| B. | Zn(s)+CuSO4 (aq)═ZnSO4 (aq)+Cu(s);△H=-216kJ•mol-1.则反应物总能量<生成物总能量 | |
| C. | 101kPa时,2H2(g)+O2(g)═2H2O(l);△H=-QkJ•mol-1,则H2的燃烧热为$\frac{1}{2}$QkJ•mol-l | |
| D. | H+(aq)+OH- (aq)=H2O(l);△H=-57.3 kJ•mol-1,含1mol NaOH的氢氧化钠溶液与含0.5mol H2SO4的浓硫酸混合后放出57.3kJ的热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
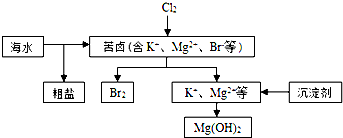
| A. | 向苦卤中通入Cl2是为了提取溴 | |
| B. | 粗盐可采用除杂和重结晶等过程提纯 | |
| C. | 富集溴一般先用空气和水蒸气吹出单质溴,在用SO2将其还原吸收 | |
| D. | 工业生产中常选用NaOH作为沉淀剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ca(HCO3)2溶液中加入少量NaOH溶液:Ca2++2HCO3-+2OH-═CaCO3↓+CO32-+2H2O | |
| B. | 向NaClO溶液中通入少量SO2:2ClO-+SO2+H2O═2HClO+SO32- | |
| C. | Cl2通入水中:Cl2+H2O═2H++Cl-+ClO- | |
| D. | 向NaHSO4溶液中滴加Ba(OH)2溶液至呈中性:2H++SO42-+Ba2++2OH-═2H2O+BaSO4↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 放射元素 | B. | ⅦA族元素 | C. | 卤化银 | D. | ⅠA族元素 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com