
| A. | 用托盘天平称取8.84 g食盐 | |
| B. | 用220 mL容量瓶配制所需的220 mL 0.1 mol/L NaOH溶液 | |
| C. | 用量筒量取12.12 mL盐酸 | |
| D. | 用0.1200 mol/L盐酸滴定未知浓度的NaOH溶液,消耗盐酸21.40 mL |
分析 A、根据托盘天平一般能精确到0.1g进行解答;
B、容量瓶的规格中没有220mL的容量瓶,可以选择250mL的容量瓶来配置溶液,计算时应用250mL计算;
C、量筒的精确度为0.1mL;
D、滴定管数值准确到0.01mL.
解答 解:A、用托盘天平称得实验的质量是8.84g,实验记录错误,因为不可能精确到0.01g,只能到0.1g,故A错误;
B、没有220mL的容量瓶,可以选择250mL的容量瓶来配置溶液,故B错误;
C、用量筒量取的盐酸体积只能精确到小数点后面一位,故C错误;
D、用0.1200mol/L盐酸滴定未知浓度的NaOH溶液时,盐酸放在酸式滴定管中,滴定管数值准确到0.01mL,故D正确.
故选D.
点评 本题考查学生化学实验常用仪器数值的准确度知识,可以根据课本知识来解决,难度不大,注意平时知识的积累是关键.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
 金属镁在目前的汽车、航天、航空、机械制造、军事等产业中得到迅猛发展.
金属镁在目前的汽车、航天、航空、机械制造、军事等产业中得到迅猛发展.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学实验产生的废液应及时倒入下水道 | |
| B. | 实验室的废酸或废碱可用中和法来处理 | |
| C. | 实验用剩的钾、钠等金属要即时扔进废液缸 | |
| D. | 如果酸洒在实验桌上,立即用氢氧化钠溶液中和 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用量筒量取液体时,视线与量筒内凹液面最低处保持水平 | |
| B. | 稀释浓硫酸时,把浓硫酸慢慢倒入盛有水的量筒中并搅拌 | |
| C. | 用胶头滴管向试管中加入液体时,胶头滴管紧贴试管内壁 | |
| D. | 检查容量瓶是否漏水的方法是往瓶中注入适量的水,倒转检查是否漏水即可 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ① | B. | ② | C. | ③ | D. | ④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CuFeS 2 仅作还原剂,硫元素被氧化 | |
| B. | 每生成1mol Cu2 S,有4 mol硫被氧化 | |
| C. | SO 2 只是氧化产物,FeS只是还原产物 | |
| D. | 每转移1.2 mol电子,有0.2mol硫被氧化 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
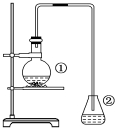 为探究苯与溴的取代反应,甲用如图装置进行如下实验:将一定量的苯和溴放在烧瓶中,同时加入少量铁屑,3~5min后发现滴有AgNO3的锥形瓶中有浅黄色的沉淀生成,即证明苯与溴发生了取代反应.
为探究苯与溴的取代反应,甲用如图装置进行如下实验:将一定量的苯和溴放在烧瓶中,同时加入少量铁屑,3~5min后发现滴有AgNO3的锥形瓶中有浅黄色的沉淀生成,即证明苯与溴发生了取代反应. ②中离子方程式为Br-+Ag+═AgBr↓.
②中离子方程式为Br-+Ag+═AgBr↓.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com