
| 族周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | A | |||||||
| 2 | B | C | D | E | ||||
| 3 | F | G | H | I | J | K | M | N |
分析 由元素在周期表中位置可知:A为H元素、B为C元素、C为N元素、D为F元素、E为He元素、F为Na元素、G为Mg元素、H为Al元素、I为Si元素、J为P元素、K为S元素、M为Cl元素、N为Ar元素,
(1)以上各元素中,非金属性最强的为F,没有正价;还原性最强的单质为金属钠;
(2)金属性越强,其最高价氧化物的水化物的碱性越强;非金属性越强,最高价氧化物的水化物酸性越强,F没有最高价,则最高价氧化物对应水化物酸性最强的为Cl元素;最高价氧化物对应的水化物呈两性的氢氧化铝;
(3)熔点的一般规律:原子晶体>离子晶体>分子晶体;
(4)原子的电子层越多,原子半径越大,电子层相同时,原子的核电荷数越大,原子半径越小,据此判断该原子半径大小.
解答 解:由元素在周期表中位置可知:A为H元素、B为C元素、C为N元素、D为F元素、E为He元素、F为Na元素、G为Mg元素、H为Al元素、I为Si元素、J为P元素、K为S元素、M为Cl元素、N为Ar元素,
(1)以上各元素中,非金属性最强的为F,F没有正价,形成单质氧化性最强为F2;还原性最强的单质为Na,
故答案为:F;F2;Na;
(2)金属性越强,其最高价氧化物的水化物的碱性越强,金属性最强的是Na,其最高价氧化物的水化物为NaOH,其碱性最强;非金属性越强,最高价氧化物的水化物酸性越强,则酸性最强的为高氯酸;最高价氧化物对应的水化物呈两性的氢氧化铝,
故答案为:氢氧化钠;高氯酸;氢氧化铝;
(3)A、B、C、D、F、H、I形成的单质分别为氢气、C、氮气、氟气、钠、铝、硅,其中C的单质和Si的单质是原子晶体,由于C单质中原子半径硅单质中原子半径小,共价键键能大,所以C的单质的熔点最高,即C(金刚石);
故答案为:C(金刚石);
(4)原子的电子层越多,原子半径越大,电子层相同时,原子的核电荷数越大,原子半径越小,则各原子的原子半径大小为:Na>Mg>Al>C>N>F,
故答案为:Na>Mg>Al>C>N>F.
点评 本题考查了元素周期表与元素周期律的综合应用,题目难度中等,熟练掌握元素周期表结构、元素周期律的内容为解答关键,试题培养了学生灵活应用基础知识的能力.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 常温下,向10mL0.1mol•L-1H2A溶液中滴加0.1mol•L-1NaOH:溶液.有关微粒的物质的量变化如图(其中I代表、H2A,Ⅱ代表ⅡAⅢ代表A2-).根据图示判断,下列说法不正确的是( )
常温下,向10mL0.1mol•L-1H2A溶液中滴加0.1mol•L-1NaOH:溶液.有关微粒的物质的量变化如图(其中I代表、H2A,Ⅱ代表ⅡAⅢ代表A2-).根据图示判断,下列说法不正确的是( )| A. | 当V(NaOH)=10mL时,溶液中离子浓度的关系一有定:c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-) | |
| B. | 当V(NaOH)=15mL时,溶液中离子浓度的关系一定有:c(HA-)+2c(H+)+3c(H2A)=c(A2-)+2c(OH-) | |
| C. | 当V(NaOH)=15mL时,向溶液中滴加少量的盐酸或NaOH溶液,溶液的pH保持不变 | |
| D. | 当V(NaOH)=20mL时,向溶液中加水稀释,c(H+)减小,Kw不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向碳酸氢钙溶液中加入过量氢氧化钠Ca2++2HCO3-+2OH-═CaCO3↓+2H2O+CO32- | |
| B. | 金属铝溶于盐酸中:Al+2H+═Al3++H2↑ | |
| C. | 氢氧化铝与足量盐酸反应Al(OH)3+3H+═Al3++3H2O | |
| D. | 少量CO2通入氢氧化钠溶液中CO2+2OH-═CO32-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 离 子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 浓度/mol•L-1 | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 $→_{△}^{H_{2}SO_{4}.SO_{3}(发烟硫酸)}$
$→_{△}^{H_{2}SO_{4}.SO_{3}(发烟硫酸)}$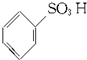
 $\stackrel{Fe,HCl,H_{2}O}{→}$
$\stackrel{Fe,HCl,H_{2}O}{→}$
 $\stackrel{NaClO}{→}$
$\stackrel{NaClO}{→}$

 C
C D
D .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加热金属钠与氧气制取氧化钠 | B. | 用二氧化硫漂白粉丝、银耳 | ||
| C. | 晶体硅是良好的半导体材料 | D. | S可用于一步制取SO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CaCl2的电离方程式:CaCl2═Ca2++2Cl- | |
| B. | 乙醇的结构简式:C2H6O | |
| C. | 氟的原子结构示意图: | |
| D. | 次氯酸的电子式: |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com