
科目:高中化学 来源:不详 题型:单选题
| A.标准状况下,11.2LH2O所含的水分子数目为0.5NA |
| B.16gO2和O3的混合气体中所含的氧原子数目为NA |
| C.1L 1.00mol·L-1 Na2CO3溶液中所含CO32-的数目为1NA |
| D.0.1molZn与含0.lmolHCl的盐酸溶液充分反应,转移电子数目为0.2NA |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.阿伏加德罗常数是12 g 14C中所含的碳原子数 |
| B.阿伏加德罗常数是 0.012 kg 12C中所含的质子数 |
| C.阿伏加德罗常数是6.02×1023 mol-1 |
| D.阿伏加德罗常数的符号为NA,近似值为6.02×1023 mol-1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
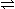 2NO2
2NO2查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.在密闭容器中加入l.5mol H2和0.5molN2,充分反应后可得到NH3分子数为NA |
| B.一定条件下,2.3g的Na完全与O2反应生成3.6g产物时失去的电子数为0.1NA |
| C.1.0L 0.1 mol·L-1Na2CO3溶液中含有的CO32-离子数为0.1NA |
| D.标准状况下,22.4L的CCl4中含有的CCl4分子数为NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com