
【题目】海洋中有丰富的食品、矿产、能源、药物和水产等资源,如图表示海水综合利用的部分过程.下列说法不正确的是( ) 
A.工业上通过电解熔融状态MgCl2制取金属镁
B.用澄清石灰水可鉴别NaHCO3和Na2CO3
C.在第②、④步骤中,溴元素均被氧化
D.制取NaHCO3的反应中,利用了其溶解度在相同条件下小于NaCl的性质
科目:高中化学 来源: 题型:
【题目】已知下列反应的热化学方程式为:
1)C(s)+O2(g)=CO2(g)△H1=﹣393.5kJ/mol
2)CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l)△H2=﹣870.3kJ/mol
3)H2(g)+ ![]() O2(g)=H2O(l)△H3=﹣285.8kJ/mol
O2(g)=H2O(l)△H3=﹣285.8kJ/mol
则反应2C(s)+2H2(g)+O2(g)=CH3COOH(l) 的反应热(焓变)为( )
A.+488.3kJ/mol
B.﹣488.3kJ/mol
C.﹣244.15kJ/mol
D.+244.15kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有一混合物的水溶液,只可能含有以下离子中的若干种:K+、![]() 、Cl-、Mg2+、Ba2+、
、Cl-、Mg2+、Ba2+、![]() 、
、![]() ,现取三份100mL溶液进行如下实验:
,现取三份100mL溶液进行如下实验:
第一份加入AgNO3溶液有沉淀产生;
第二份加足量NaOH溶液加热后,收集到0.08mol气体;
第三份加足量BaCl2溶液后,得干燥沉淀12.54g,经足量盐酸洗涤、干燥后,沉淀质量为4.66g。
(已知, ![]() +OH-
+OH-![]() H2O+NH3↑)
H2O+NH3↑)
根据上述实验,回答以下问题。
(1)由第一份进行的实验推断该混合物是否一定含有Cl-?____________(答是或否)。
(2)由第二份进行的实验得知混合物中应含有____________(填离子符号),其物质的量浓度为____________。
(3)由第三份进行的实验可知12.54g沉淀的成分为____________。
(4)综合上述实验,你认为以下结论正确的是(______)
A.该混合液中一定含有K+、![]() 、
、![]() 、
、![]() ,可能含Cl-,且n(K+)≥0.04mol
,可能含Cl-,且n(K+)≥0.04mol
B.该混合液中一定含有![]() 、
、![]() 、
、![]() ,可能含K+、Cl-
,可能含K+、Cl-
C.该混合液中一定含有![]() 、
、![]() 、
、![]() ,可能含Mg2+、K+、Cl-
,可能含Mg2+、K+、Cl-
D.该混合液中一定含有![]() 、
、![]() ,可能含Mg2+、K+、Cl-
,可能含Mg2+、K+、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度不同压强(P1>P2)下,可逆反应2X(g)2Y(g)+Z(g)中,生成物Z在反应混合物中的体积分数(Z%)与反应时间(t)的关系有以下图示,正确的是( )
A.
B.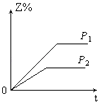
C.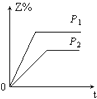
D.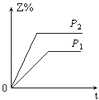
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有金属单质A、B和气体甲、乙、丙及物质C、D、E、F、G,它们之间能发生如图反应(图中某些反应的产物及条件没有全部标出)

根据以上信息填空:
(1)写出下列物质的化学式:A______ G__________ ;
(2)纯净的气体甲在气体乙中燃烧的现象:______________________________________;
(3)写出下列反应的离子方程式:反应①_________________________;反应④____________________________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下物质之间的每步转化中,都能通过一步实现的是( )
①Fe→FeCl2→Fe(OH)2→ Fe(OH)3
②Na→Na2O→Na2CO3→NaHCO3→NaOH
③Mg→MgCl2→Mg(OH)2
④Al→Al2O3→Al(OH)3
⑤Al→NaAlO2→Na2CO3
A. ②③④ B. ①③④⑤ C. ①②③⑤ D. ①②③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铬铁矿的主要成分可以表示为FeOCr2O3 , 还含有SiO2、Al2O3杂质,以铬铁矿为原料制备重铬酸钾(K2Cr2O7)过程如图所示. 
已知:CrO42﹣和Cr2O72﹣在酸性条件下可以相互转化.
请回答下列问题:
(1)完成并配平下列方程式: 6FeO+6Cr2O3+KOH+KClO3=K2CrO4+Fe2O3+KCl+
(2)滤渣1的成分是(填化学式),滤液1的成分除K2CrO4、KClO3、KOH外,还含有(填化学式),过滤后洗涤沉淀的操作是 .
(3)试剂1是(填化学式),利用滤渣2可制得两种氧化物,其中一种氧化物经电解冶炼可获得金属,电解时阴极的电极反应式为 .
(4)对滤液2用稀硫酸酸化处理时发生的离子反应方程式是 , 酸化处理时往往增大稀硫酸浓度的原因是 .
(5)检验氯酸钾晶体中钾元素的具体方法是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳酸锂(相对分子质量74)广泛应用于化工、冶金等行业.工业上利用锂辉石(Li2Al2Si4Ox)制备碳酸锂的流程如图: 
已知:碳酸锂的溶解度为((g/L)
温度 | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 80 | 100 |
Li2CO3 | 1.54 | 1.43 | 1.33 | 1.25 | 1.17 | 1.08 | 1.01 | 0.85 | 0.72 |
请回答下列问题:
(1)锂辉(Li2Al2Si4Ox)可以用氧化物的形式表示其组成,形式为
(2)硫酸化焙烧温度控制在250℃﹣300℃之间,主要原因是 . 焙烧中硫酸用量控制在理论用最的l15%左右,硫酸加入过多的副作用是 .
(3)水浸时,加入CaCO3粉末充分反应后过滤,滤渣的主要成分除CaCO3外还有 .
(4)“沉锂”的化学反应方程式为 .
(5)“沉锂”需要在95℃以上进行,主耍原因是 . 过滤碳酸锂所得母液中主要含有硫酸钠,还可能含有和 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,投入4molSO2和4mol氧气,到2L的密闭容器中,反应达到平衡时n(SO2)+n(O2)=n(SO3),求二氧化硫的转化率和此温度下的平衡常数.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com