
| A. | 1 | B. | 2 | C. | 3 | D. | 4 |
科目:高中化学 来源: 题型:选择题
| A. | 中和反应是吸热反应 | |
| B. | 燃烧属于放热反应 | |
| C. | 化学键断裂放出能量 | |
| D. | 吸热反应中,反应物总能量大于生成物总能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.0 L 1.0 mol•L-1的NaAlO2水溶液中含有的氧原子数为2NA | |
| B. | 23 g Na与足量H2O反应完全后可生成NA个H2分子 | |
| C. | 标准状况下,11.2 L CH3CH2OH中含有的分子数目为0.5NA | |
| D. | 常温常压下,46 g的NO2与N2O4混合物含有的原子数为3 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H+、Fe2+、I-、NO3- | B. | Al3+、AlO2-、SO42-、Cl- | ||
| C. | K+、Ag+、Ca2+、NO3- | D. | NH4+、Na+、OH-、MnO4- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SiO2晶体结构中,每个Si原子与2个O原子直接相连 | |
| B. | 通常状况下,60gSiO2晶体中含有的分子数为NA(NA表示阿伏加德罗常数) | |
| C. | 12g金刚石含4molC-C键 | |
| D. | 金刚石网状结构中,由共价键形成的碳原子环中,最小的环上有6个碳原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol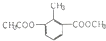 能与4molNaOH充分反应 能与4molNaOH充分反应 | |
| B. |  系统命名法为3-丁烯 系统命名法为3-丁烯 | |
| C. |  的碳原子都在一个平面内,且它的二氯代物为3种 的碳原子都在一个平面内,且它的二氯代物为3种 | |
| D. | 1mol 可以与4molH2发生加成 可以与4molH2发生加成 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 微粒半径Na+<K+<Cl-<S2- | B. | 稳定性HI>HBr>HCl>HF | ||
| C. | 酸性H2SiO3<H3PO4<H2SO4<HClO4 | D. | 碱性KOH>Ca(OH)2>Mg(OH)2>Al(OH)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
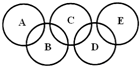 如图所示的五元环代表A、B、C、D、E五种化合物,圆圈交叉部分指两种化合物含有一种相同元素,五种化合物由五种短周期元素形成,每种化合物仅含两种元素,A是沼气的主要成分,B、E分子中所含电子数均为18,B不稳定,具有较强的氧化性,其稀溶液是医疗上广泛使用的消毒剂,E的分子结构模型为
如图所示的五元环代表A、B、C、D、E五种化合物,圆圈交叉部分指两种化合物含有一种相同元素,五种化合物由五种短周期元素形成,每种化合物仅含两种元素,A是沼气的主要成分,B、E分子中所含电子数均为18,B不稳定,具有较强的氧化性,其稀溶液是医疗上广泛使用的消毒剂,E的分子结构模型为 ,C可作为光导纤维的主要材料,D中所含两种元素的原子个数比为3:4,电子总数之比为3:2.根据以上信息回答下列问题:
,C可作为光导纤维的主要材料,D中所含两种元素的原子个数比为3:4,电子总数之比为3:2.根据以上信息回答下列问题: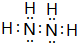 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com