
【题目】下表标出的是元素周期表的一部分元素。
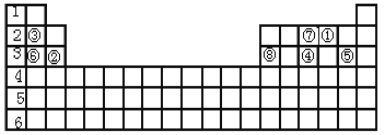
根据上表回答下列问题。
(1)元素①的原子序数是____,由元素①构成三原子单质的分子名称是____。
(2)元素④与⑦相比,____元素的原子半径较大,____元素的氢化物更稳定(用元素符号填写)。
(3)元素③与⑥相比,最高价氧化物对应水化物碱性较大的是________(填碱的化学式)。
(4)元素②和⑧的氧化物常用做耐火材料。元素②的氧化物的化学式是______,元素⑧的氢氧化物与烧碱溶液反应的化学方程式是____________。
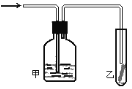
(5)如图,将潮湿的由元素⑤构成的单质通过甲装置后,再通过放有干燥红色布条的乙装置,红色布条不褪色。则甲装置中所盛试剂可能是______。
a.稀硫酸 b.浓硫酸 c.水 d.饱和食盐水
【答案】8 臭氧 P N NaOH MgO Al(OH)3+NaOH=NaAlO2+2H2O b
【解析】
根据元素周期表中元素的位置关系,①为氧;②为镁;③为锂;④为磷;⑤为氯;⑥为钠;⑦为氮;⑧为铝。
(1)元素①为氧元素,原子序数是8,由氧元素构成三原子单质的分子名称是臭氧。
答案为:8;臭氧。
(2)元素P与N为同族元素,从上至下,原子半径依次增大,非金属性依次减弱,P元素的原子半径较大,非金属性越强元素的氢化物更稳定,非金属性:N>P,则N元素的氢化物更稳定。
答案为:P ; N。
(3)元素Li与Na为同族元素,从上至下金属性逐渐增强,金属性Li<Na,金属性越强,对应的最高价氧化物对应水化物碱性越强,碱性较大的是NaOH。
答案为:NaOH。
(4)元素镁和铝的氧化物常用做耐火材料。元素镁的氧化物的化学式是MgO,氢氧化铝与氢氧化钠溶液反应生成偏铝酸钠和水,化学方程式是Al(OH)3+NaOH=NaAlO2+2H2O。
答案为:Al(OH)3+NaOH=NaAlO2+2H2O。
(5)由元素⑤构成的单质为氯气;
a.潮湿的氯气通过稀硫酸,稀硫酸无吸水性,从甲中出来的气体仍然是潮湿的氯气,能使干燥的有色布条褪色,故a不符合;
b.潮湿的氯气通过浓硫酸,浓硫酸有吸水性,从甲中出来的气体是干燥的氯气,干燥的氯气不能使干燥的有色布条褪色,故b符合;
c.潮湿的氯气通过水氯气可溶于水,也可与水反应,从甲中出来的未完全反应的气体仍然是潮湿的氯气,能使干燥的有色布条褪色,故c不符合;
d.潮湿的氯气通过饱和食盐水,饱和食盐水没有吸水性,不溶解氯气,从甲中出来仍然是潮湿的氯气,能使干燥的有色布条褪色,故d不符合;
答案选b。


科目:高中化学 来源: 题型:
【题目】已知两种常见金属A(地壳中含量第二的金属)、B(红色金属)分别与两种酸X、Y发生反应,其转化关系如图所示,其中D为红棕色气体。
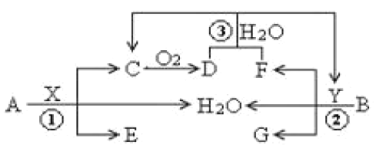
回答以下问题:
(1)反应③的离子反应方程式为___;
(2)6.4gB与过量X溶液(8mol /L、60mL)充分反应后,生成的还原产物有C、D,反应后溶液中所含X为n mol ,此时溶液中所含X的阴离子的物质的量为___mol。
(3)常温下A与Y的稀溶液能发生反应生成盐W,关于固体W的转化关系如图所示(无关物质已略去)。其中N是红棕色的化合物。

①M由两种化合物组成,其中含有F;将M通入BaCl2溶液,实验现象是___。
②若经反应I得到16 g固体N,产生的气体M恰好被0.3L1mol·L-1 NaOH溶液完全吸收得溶液1,则反应Ⅳ中发生反应的离子方程式是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Be(OH)2是两性的,跟强酸反应时生成Be2+,跟强碱反应时生成BeO22—。现有三份等物质的量浓度、等体积的BeCl2、MgCl2、AlCl3溶液(配制时均加入少量盐酸),现将一定浓度的NaOH溶液分别滴入三种溶液中至过量,NaOH溶液的体积x(mL)与生成沉淀的物质的量y(mol)的关系如图所示,则与BeCl2、MgCl2、AlCl3三种溶液对应的图像正确的是( )
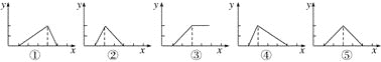
A. ⑤③① B. ②③④ C. ③⑤④ D. ③②①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】等物质的量的X(g)与Y(g)在密闭容器中进行可逆反应:X(g)+Y(g) ![]() 2Z(g)+W(s) ΔH<0,下列叙述正确的是 ( )
2Z(g)+W(s) ΔH<0,下列叙述正确的是 ( )
A. 平衡常数K值越大,X的转化率越大
B. 达到平衡时,反应速率v正(X)=2v逆(Z)
C. 达到平衡后降低温度,正向反应速率减小的倍数大于逆向反应速率减小的倍数
D. 达到平衡后,升高温度或增大压强都有利于该反应平衡向逆反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇来源丰富,价格低廉,是一种重要的化工原料,有着非常重要、广泛的用途。工业上常用水煤气在恒容、催化剂和加热的条件下生产甲醇,其热化学方程式为:2H2(g)+CO(g) ![]() CH3OH(g);ΔH=-90.8kJ/mol。
CH3OH(g);ΔH=-90.8kJ/mol。
(1)该反应的平衡常数表达式为:K=____,如升高温度,K值将______(填:增大、减小或不变)。
(2)以下各项能说明该反应达到平衡状态的是____________.
A.混合气体的密度保持不变 B.甲醇的质量分数保持不变
C.CO的浓度保持不变 D.2v逆(H2)=v正(CH3OH)
(3)在210°C、240°C和270°C三种不同温度、2 L恒容密闭容器中研究合成甲醇的规律。
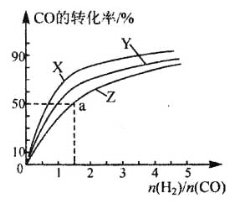
如图是上述三种温度下不同的H2和CO的起始组成比(起始时CO的物质的量均为1 mol)与CO平衡转化率的关系,则曲线Z对应的温度是_____。由起始达到a点所需时间为5min,则H2的反应速率为:_______________mol/(L·min)。
(4)某兴趣小组设计了如图所示的甲醇燃料电池装置。
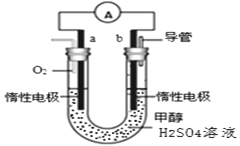
①该电池工作时,正极是____________极(填“a”或 “b”);
②该电池负极反应的离子方程式为____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】莲花清瘟对新型冠状病症状的改善有一定作用,其成分中含有“金银花”。中药“金银花”抗菌杀毒有效成分是“绿原酸”。以下是科研小组设计的“绿原酸”的合成路线:
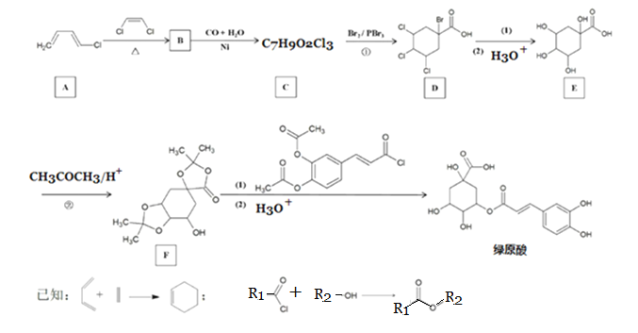
回答下列问题:
(1)有机物A的名称是__________。
(2)反应①的反应类型是__________。
(3)若碳原子上连有4个不同的原子或基团时,该碳原子称为手性碳。写出有机物B的结构简式,用星号(*)标出B中的手性碳__________。
(4)反应D→E中第(1)步的反应方程式是__________。
(5)有机物F中官能团的名称是__________。
(6)反应②的目的是__________。
(7)有机物C的同分异构体有多种,满足以下条件的还有______种。(不考虑立体异构)
a. 具有六元碳环结构;
b. 含有3个氯原子,且同一碳原子上只能连接一个氯原子;
c. 能与NaHCO3溶液反应产生无色无味气泡。
(8)参照上述合成方法,设计由丙酸为原料制备高吸水性树脂聚丙烯酸钠的合成路线如图。
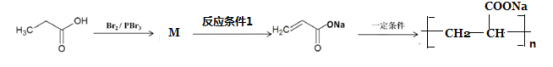
写出M结构简式__________;反应条件1为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na、Fe、N是中学化学常见的三种元素,请依据这些元素组成的物质回答下列问题:
(1)钠可以和TiCl4反应制取金属Ti,体现钠的__性。
(2)氯碱工业是利用电解氯化钠溶液制取烧碱和氯气,其反应为:2NaCl+2H2O![]() 2NaOH+Cl2↑+H2↑,该反应的离子方程式___;氯气有毒,可以用__吸收。
2NaOH+Cl2↑+H2↑,该反应的离子方程式___;氯气有毒,可以用__吸收。
(3)写出Fe2O3的一种用途__,请设计实验证明赤铁矿中含有铁元素___。
(4)电子工业常用FeCl3溶液刻蚀印刷电路板(由高分子材料和铜箔复合而成),离子方程式为__。
(5)将一小块Cu片放入盛有稀硝酸的试管中,可观察到试管口气体颜色为__;其铜和稀硝酸反应的离子方程式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列叙述正确的是( )
A. 标况下,224 L H2O含有的分子数为10NA
B. 1 mol任何气体所含的原子数均为NA
C. 28 g CO所含的分子数为NA
D. 标况下,NA个分子的体积为22.4 L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是某化学兴趣小组探究不同条件下化学能转变为电能的装置。请回答下列问题:
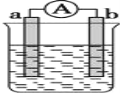
(1)当电极a为Al,电极b为Cu,电解质溶液为稀硫酸时,正极的电极反应式为:__________
(2)当电极a为Al,电极b为Mg,电解质溶液为氢氧化钠溶液时,该装置__________(填“能”或“不能”)形成原电池,若不能,请说明理由;若能,请指出正、负极材料:__________。当反应中收集到标准状况下224mL气体时,消耗的电极质量为__________g。
(3)燃料电池工作原理是将燃料和氧化剂(如O2)反应产生的化学能直接转化为电能。现设计一燃料电池,以电极a为正极,电极b为负极,甲烷为燃料,采用氢氧化钠溶液为电解液;则甲烷应通入________极(填a或b,下同),
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com