

| 物质 | SiCl4 | AlCl3 | FeCl3 | FeCl2 | NaCl |
| 沸点/℃ | 57.6 | 180(升华) | 300(升华) | 1023 | 801 |
分析 用铝土矿制取无水氯化铝工艺流程:铝土矿粉和焦炭在300℃焙烧,固体水分挥发、气孔数目增多,固体混合物和氯气、氧气在950℃加热,Al2O3、Fe2O3和SiO2先被焦炭还原为Al、Fe、Si,该过程生成CO,后Al、Fe、Si分别和Cl2反应生成对应的氯化物,即SiCl4、AlCl3、FeCl3,CO和O2反应生成CO2,后冷却到100℃,尾气为CO2、多余的Cl2,O2,SiCl4,以及AlCl3和FeCl3变成固体,得到氯化铝的粗品,加入氯化钠熔融,铝的金属活动性强于铁,加铝粉,可以将氯化铝的粗品中的氯化铁中的铁置换出来,生成铁和氯化铝,在300℃,废渣为Fe,得到成品氯化铝,据此答题.
解答 解:(1)步骤1中铝土矿粉和焦炭在300℃焙烧,因后续步骤反应生成氯化铝等强酸弱碱盐易水解,固体水分在焙烧的过程中挥发,防止后续步骤生成的盐水解、气孔数目增多增大反应物的接触面积,加快反应速率,
故答案为:防止后续步骤生成的AlCl3水解或增大反应物的接触面积,加快反应速率;
(2)高温反应后,由Al2O3、C和Cl2反应生成AlCl3和CO的化学方程式为Al2O3+3C+3Cl2$\frac{\underline{\;高温\;}}{\;}$2AlCl3+3CO,
故答案为:Al2O3+3C+3Cl2$\frac{\underline{\;高温\;}}{\;}$2AlCl3+3CO;
(3)根据上面的分析可知,气体Ⅱ的主要成分除了Cl2外,还含有CO2、O2、SiCl4,气体Ⅱ常用过量冷的NaOH溶液吸收,二氧化碳与氢氧化钠反应生成碳酸根离子或碳酸氢根离子,氯气与氢氧化钠反应生成氯离子和次氯酸根离子,四氯化硅水解生成硅酸根离子,所以吸收液中含有的阴离子主要有CO32-、HCO3-、Cl-、ClO-、SiO32-、OH-,
故答案为:CO2、O2、SiCl4;CO32-、HCO3-、Cl-、ClO-、SiO32-、OH-;
(4)工业上为了降低生产成本,生产过程中需要控制加入铝粉的量,可以将氯化铝的粗品中的氯化铁还原成氯化亚铁,这样可以通过升华分离出AlCl3,所以废渣为NaCl、FeCl2,
故答案为:NaCl、FeCl2;
(5)AlCl3和NaCl的熔融盐常用于镀铝电解池,电镀时AlCl4-和Al2Cl7-两种离子在电极上相互转化,其它离子不参与电极反应,则电镀时阴极上发生还原反应,反应的电极反应式为4Al2Cl7-+3e-=7AlCl4-+Al,
故答案为:4Al2Cl7-+3e-=7AlCl4-+Al.
点评 本题考查工业上用铝土矿盐制取无水氯化铝工艺,涉及硅、铁、铝及其化合物的性质,注意盐的水解、生产流程反应条件的控制、电极反应方程式的书写等,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | .甲烷的比例模型: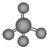 | B. | .氯离子的结构示意图: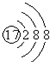 | ||
| C. | CO2分子的电子式: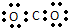 | D. | .中子数为18的硫原子:${\;}_{16}^{34}$S |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 肯定有Na+、Al3+、Mg2+、SO42- | B. | 肯定有Na+、Mg2+、Al3+、Cl- | ||
| C. | 肯定没有Mg2+、HCO3-、MnO4-、Cl- | D. | 肯定没有K+、NH4+、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  | B. |  | C. |  | D. |  |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
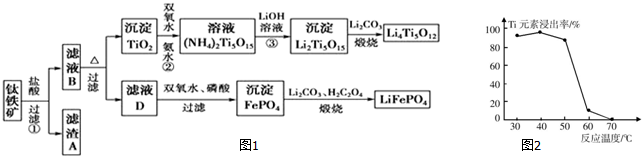
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;锂暴露在湿空气中时,会迅速地失去金属光泽、表面开始变黑,更长时间则变成白色.生成的化合物是氮化锂、氢氧化锂,最终生成碳酸锂.写出生成氮化锂的化学方程式6Li+N2=2Li3N.
;锂暴露在湿空气中时,会迅速地失去金属光泽、表面开始变黑,更长时间则变成白色.生成的化合物是氮化锂、氢氧化锂,最终生成碳酸锂.写出生成氮化锂的化学方程式6Li+N2=2Li3N.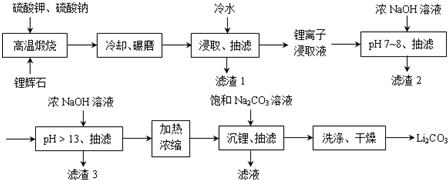
| 金属离子 | Al(OH)3 | Fe(OH)2 | Fe(OH)3 | Mn(OH)2 |
| 沉淀完全的pH | 4.7 | 9.0 | 3.2 | 10.1 |
| 温度 溶解度 | 10℃ | 20℃ | 50℃ | 80℃ |
| Li2SO4 | 35.4 | 34.7 | 33.1 | 31.7 |
| Li2CO3 | 1.43 | 1.33 | 1.08 | 0.85 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
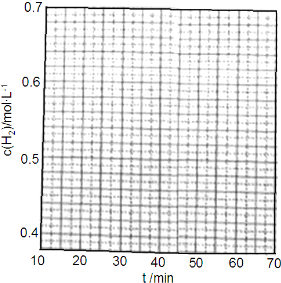
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 丁烷的球棍模型 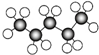 | B. | 乙烯的比例模型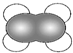 | ||
| C. | 乙醛的结构简式CH3COH | D. | 键线式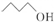 表示的有机物名称为1-戊醇 表示的有机物名称为1-戊醇 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com