
| A、+1 | B、+2 | C、+4 | D、+5 |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| A、该反应说明钠是强还原剂,可用于冶炼金属 |
| B、TiCl4是还原剂 |
| C、该反应也可以在水溶液中进行 |
| D、该反应中Ti元素被氧化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、镁、铝一样多 |
| B、钠放出的多 |
| C、镁放出的多 |
| D、铝放出的多 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、反应中还原产物是NO |
| B、氧化产物和还原产物的物质的量之比为1:4 |
| C、反应过程中转移的电子数为8e- |
| D、化学方程式中按物质顺序的化学计量数是8、2、5、1、4、1、5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②④⑥ | B、②③④⑥ |
| C、②③④ | D、②③④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、AlCl3溶液中滴加足量氨水:Al3++4OH-═AlO2-+2H2O |
| B、氢氧化钙悬浊液中滴加盐酸:H++OH-═H2O |
| C、NaAlO2溶液中通入过量CO2:AlO2-+CO2+2H2O═Al(OH)3↓+HCO3- |
| D、MaSO4溶液中加入Ba(OH)2溶液:SO42-+Ba2+═BaSO4↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 3 |
| 2 |
| 4 |
| 2 |
A、
| ||||
B、
| ||||
C、
| ||||
D、
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| 温度/℃ | 25 | t1 | t2 |
| 水的离子积常数 | 1×10-14 | a | 1×10-12 |
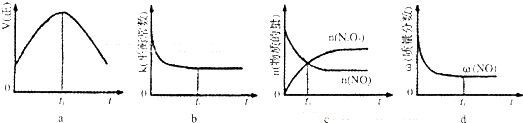
查看答案和解析>>
科目:高中化学 来源: 题型:
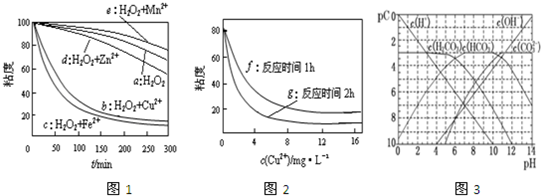
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com