
【题目】下面是混合物分离的实验,请回答有关问题
实验:通过蒸馏的方法除去自来水中含有的氯离子等杂质制取纯净水,如图所示
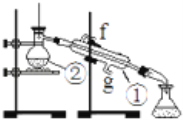
(1)写出下列仪器的名称:①________②________。
(2)若利用以上装置分离酒精和四氯化碳两种溶液的混合物,还缺少的仪器是________,图中装置中进水口是________。(填“f”或“g”)
(3)仪器①中常加入碎瓷片,这样做的目的是________。
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】某无色溶液Y可能含有Na+、Fe3+、Ba2+、NH4+、Cl-、SO42-、HCO3-、HSO3-中的几种离子,溶液中阳离子浓度相同。为了确定其组成,某同学进行了如下实验(假设气体均全部逸出,忽略H2O2的分解)。下列说法不正确的是
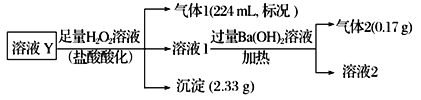
A. 溶液Y中一定不存在Fe3+、SO42-
B. 溶液Y中一定含有Cl-,且n(Cl-)=0.01 mol
C. 溶液Y中肯定存在HCO3-、HSO3-、Ba2+、NH4+
D. 溶液Y中可能存在Na+,为确定其是否存在,可取溶液1通过焰色反应实验验证
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组以绿矾(FeSO47H2O)为原料制备化合物A[K3Fe(Ⅲ) (C2O4)xyH2O]并通过如下实验步骤确定A的化学式:
步骤1:准确称取A样品4.91g,干燥脱水至恒重,残留物质量为4.37g;
步骤2:将步骤1所得固体溶于水,经测定含Fe3+0.0l00mol;
步骤3:准确称取A样品4.91g置于锥形瓶中,加入足量的3. 00mol-L'1的H2SO4,溶液和适量蒸馏水,用0.500molL-1的KMnO4溶液滴定,当MnO4-恰好完全被还原为 Mn2+时,消耗KMnO4溶液的体积为24.00 mL。
请回答下列问题:
(1)绿矾(FeSO47H2O)若保存不当或长期放置,易与空气中的氧气反应,该反应中 FeSO4表现的性质为_____(填字母)。
A.氧化性 B.还原性 C.氧化性和还原性 D.酸性
(2)用物质的量浓度为18.0 molL-1的浓硫酸配制100mL3.00 molL-1的H2SO4溶液时,量取浓硫酸需要的量筒规格为_____(填字母)。
A.10mL B.25mL C.50mL D.l00mL
(3)步骤2发生的离子反应如下,将该离子方程式配平:_____MnO4-+_____ C2O42-+_____H+=_____Mn2++_____CO2↑+_____H2O。
通过计算确定化合物A中x、y的值(请写出计算过程)。_____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】喹啉醛H 是一种可用于制备治疗肿瘤药物的中间体。由烃A制备H的合成路线如下:
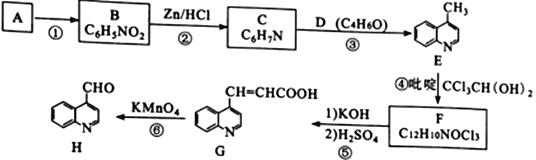
巳知:i.RCCl3![]() RCOOK;ii.反应④中,吡啶作稳定剂
RCOOK;ii.反应④中,吡啶作稳定剂
回答下列问题:
(1)A的化学名称是__________________________。
(2)①、⑥的反应类型分别为_______________、________________。
(3)D为链状结构,分子中不含“—O—”结构,且不能发生银镜反应,其核磁共振氢谱为3组峰,峰面积比为3:2:1,D的结构简式为________________________。
(4)反应④的化学方程式为______________________________________。
(5)下列有关G的说法正确的是________________ (填标号)。
a.经质谱仪测定,G只含有羧基、碳碳双健两种官能团
b.属于萘的衍生物
c.一定条件下可发生加聚反应
d.可与少量Na2CO3溶液反应生成NaHCO3
(6)X是H的同分异构体,两者环状结构相同,X环上的取代基与H的相同但位置不同,则X可能的结构有____种。
(7)写出用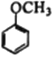 为原料制备
为原料制备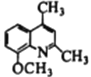 的合成路线________________(其他试剂任选)。
的合成路线________________(其他试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究化学反应原理对于生产、生活及环境保护具有重要意义。请回答下列问题:
(1)常温下,物质的量浓度均为0.1mol/L的四种溶液:①NH4I;②CH3COONa;③(NH4)2SO4;④ Na2CO3,pH从大到小排列顺序为__________(填序号)。
(2)苯乙烯是工业上合成树脂、离子交换树脂及合成橡胶等的重要单体,工业上可用乙苯催化脱氢方法制备苯乙烯:
![]() 。
。
①已知乙苯(g)、苯乙烯(g)的燃烧热分别为akJ/mol,bkJ/mol,则氢气的燃烧热为___kJ/mol(用含有Q、a、b的表达式表示,其中Q、a、b均大于0)。
②在实际生产中,在恒压条件下常以高温水蒸气作为反应体系的稀释剂(水蒸气不参加反应),此时乙苯的平衡转化率与水蒸气的用量、压强(p)的关系如下图所示。

Ⅰ.加入水蒸气稀释剂能提高乙苯转化率的原因是__________
Ⅱ.用平衡分压代替平衡浓度计算平衡常数(Kp),其中,分压=总压×物质的量分数,则900K时的平衡常数Kp=________.
Ⅲ.改变下列条件,能使乙苯的反应速率和转化率一定增大的是_______ (填字母)。
A.恒容时加入稀释剂水蒸气
B.压强不变下,温度升至1500K
C.在容积和温度不变下充入Ar
D.选用催化效果更好的催化剂
(3)利用“Na-CO2”电池将CO2变废为宝。我国科研人员研制出的可充电“Na-CO2”电池,以钠箔和多壁碳纳米管(MWCNT)为电极材料,总反应为4Na+3CO2![]() 2Na2CO3+C。放电时该电池“吸入”CO2,其工作原理如图所示:
2Na2CO3+C。放电时该电池“吸入”CO2,其工作原理如图所示:
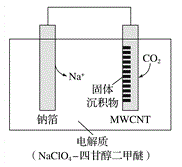
①放电时,正极的电极反应式为___________。
②若生成的Na2CO3和C全部沉积在电极表面,当转移0.2mol 电子时,两极的质量差为______g。(假设放电前两电极质量相等)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随着我国汽车年销量的大幅增加,给空气环境造成了很大的污染。汽车尾气装置里,气体在催化剂表明吸附与解吸作用的过程如图所示,下列说法正确的是
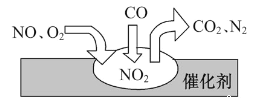
A. 反应中CO为氧化剂,N2为氧化产物
B. 催化转化总反应为2NO+O2+4CO![]() 4CO2+N2
4CO2+N2
C. NO和O2必须在催化剂表面才能反应
D. 汽车尾气的主要污染成分包括CO、NO和N2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化亚铜(CuCl)常用作有机合成工业中的催化剂,在潮湿空气中易水解氧化;见光则分解,变成褐色;CuCl难溶于醇和水,可溶于氯离子浓度较大的体系。下图是工业上用制作印刷电路的废液(含Fe3+、Cu2+、Fe2+、Cl-)
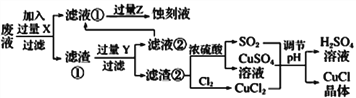
根据以上信息回答下列问题:
(1)写出生产过程中所用物质的名称:____________,________________。
(2)写出产生CuCl的化学方程式:________________________________。
(3)在CuCl的生成过程中理论上不需要补充SO2气体,结合化学方程式和必要的文字说明理由________________________________________________。实际生产中SO2要适当过量,原因可能是___(答一点即可).
(4)得到CuC1晶体后,还需要经过水洗、乙醇洗涤两步操作。用乙醇洗涤的作用是________________。
(5)实验探究pH对CuCl产率的影响如下表所示:
pH | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
CuCl产率 | 70 | 90 | 82 | 78 | 75 | 72 | 70 |
析出CuCl晶体最佳pH为_________,当pH较大时CuCl产率变低原因是________________。
(6)氯化亚铜的定量分析:
①称取样品0.25g和过量的FeCl3溶液于250mL锥形瓶中,充分溶解。
②用0.10molL-1硫酸铈标准溶液滴定。已知:CuCl+FeCl3═CuCl2+FeCl2、Fe2++Ce4+═Fe3++Ce3+。三次平行实验结果如下(平行实验结果相差不能超过1%):
平行实验次数 | 1 | 2 | 3 |
0.25g样品消耗硫酸铈标准溶液的体积(mL) | 24.35 | 24.05 | 23.95 | /tr>
则样品中CuCl的纯度为_______________(结果保留三位有效数字)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com