
| A. | 上述反应中生成的N2是火箭燃料燃烧后的氧化产物 | |
| B. | 推动火箭飞行的强大动力源于该反应瞬间产生的大量高温气体 | |
| C. | 火箭发射时看到的红棕色气体是火箭起飞后,保险活动门自动开启,排出部分高压氧化剂在空气中氧化的结果 | |
| D. | 从能量变化上看,上述反应是热能转化为动能 |
分析 在反应C2H8N2+2N2O4=2CO2↑+3N2↑+4H2O中,化学物C2H8N2中N元素的化合价为-3价,H为+1价,C为-1价,N2O4中N为+4价,根据化合价的变化解答该题.
解答 解:A.C2H8N2中N元素的化合价为-3价,反应时化合价的变化为:C化合价由-1价升高为+4价,N化合价由-3价升高为0价,反应中生成的N2是火箭燃料燃烧后的氧化产物之一,故A错误;
B.反应放热,同时生成大量气体,即推动火箭飞行的强大动力源于该反应瞬间产生的大量高温气体,故B正确;
C.N2O4能部分转化为NO2,NO2为红棕色气体,化合价不变,没有被氧化,故C错误;
D.该反应中化学能转化为热能和动能,故D错误.
故选B.
点评 本题考查氧化还原反应,注意正确分析各元素化合价的变化为解答该题的关键,侧重氧化还原反应基本概念及转移电子的考查,题目难度不大.


科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
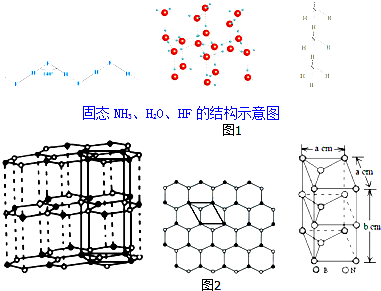
 .
.| 物质 | 氢键X-H…Y | 键能/kJ•mol-1 |
| (HF)n | F-H…F | 28.1 |
| 冰 | O-H…O | 18.8 |
| (NH3)n | N-H…N | 5.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2+O2═2H2O△H=-571.6KJ/mol | |
| B. | H2 (g)+$\frac{1}{2}$O2(g)═H2O (l)△H=-142.9KJ/mol | |
| C. | H2 (g)+$\frac{1}{2}$O2(g)═H2O (l)△H=-285.8KJ/mol | |
| D. | 2H2(g)+O2(g)═2H2O (g)△H=-571.6KJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 0.01mol•L-1 KIO3 酸性溶液(含淀粉)的体积/mL | 0.01mol•L-1 Na2SO3 溶液的体积/mL | H2O的体积 /mL | 实验 温度 /℃ | 溶液出现蓝色时所需时间/s | |
| 实验1 | 5 | V1 | 35 | 25 | |
| 实验2 | 5 | 5 | 40 | 25 | |
| 实验3 | 5 | 5 | V2 | 0 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com