
【题目】如图为氢氧燃料电池原理示意图,按照此图的提示,下列叙述不正确的是( )

A.a电极是负极
B.b电极的电极反应为:4OH--4e-====2H2O+O2↑
C.氢氧燃料电池是一种具有应用前景的绿色电源
D.氢氧燃料电池是一种不需要将还原剂和氧化剂全部储藏在电池内的新型发电装置
科目:高中化学 来源: 题型:
【题目】有反应:![]() ,
,![]() 时该反应的平衡常数
时该反应的平衡常数![]() 。
。![]() 时,将一定量的
时,将一定量的![]() 和
和![]() 充入容积为某10L密闭容器发生上述反应,5min时达平衡,
充入容积为某10L密闭容器发生上述反应,5min时达平衡,![]() 只改变了一个条件,10min时再次达平衡,各物质物质的量
只改变了一个条件,10min时再次达平衡,各物质物质的量![]() 变化如下:
变化如下:
0min | 5min | 10min | |
CO |
|
| |
|
|
| |
| 0 |
| |
| 0 |
|
下列说法正确的是![]()
A.![]() 时用
时用![]() 表示的平均反应速率为
表示的平均反应速率为![]()
B.![]() 改变的条件是再加入了
改变的条件是再加入了![]()
![]()
C.![]() 时,若向容器中充入
时,若向容器中充入![]()
![]() 、
、![]()
![]() 、
、![]() 、
、![]() ,达平衡时,
,达平衡时,![]() 的浓度为
的浓度为![]()
D.![]() 时,若向容器中充入
时,若向容器中充入![]()
![]() 、
、![]()
![]() 、
、![]() 、
、![]()
![]() 正
正![]() 逆
逆![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在含有弱电解质的溶液中,往往有多个化学平衡共存。
(1)一定温度下,向 1L 0.1mol·L-1 CH3COOH 溶液中加入 0.1molCH3COONa 固体,则溶液中![]() _____(填“增大”、“不变”或“减小”);写出该溶液中的电荷守恒关系_____。
_____(填“增大”、“不变”或“减小”);写出该溶液中的电荷守恒关系_____。
(2)土壤的 pH 一般在 4~9 之间。土壤中 Na2CO3 含量较高时,pH 可达 10.5,试用离子方程式解释土壤呈碱性的原因:_____。加入石膏(CaSO4·2H2O)可以使土壤碱性降低,有关反应的化学方程式为_____。
(3)水垢的主要成分 CaCO3 可以用过量食醋溶解,请结合化学用语,从沉淀溶解平衡的角度进行解释______________。
(4)常温下在 20mL0.1mol·L-1Na2CO3 溶液中逐滴加入 0.1mol·L-1HCl 溶液 40mL,溶液中含碳元素的各种微粒(CO2 因逸出未画出)物质的量分数(纵轴)随溶液 pH 变化的部分情况如图所示。回答下列问题:

①在同一溶液中 H2CO3 和CO![]() ____________________(填“能”或“不能”)大量共存。
____________________(填“能”或“不能”)大量共存。
②当 pH=7 时,溶液中含碳元素的最主要微粒为_____,溶液中各种离子的物质的量浓度的大小关系为_________。
③已知在 25℃时,CO![]() 水解反应的平衡常数
水解反应的平衡常数 =2.0×10-4,当溶液中c(HCO
=2.0×10-4,当溶液中c(HCO![]() ):c(CO
):c(CO![]() )=2:1 时,溶液的 pH=_____。
)=2:1 时,溶液的 pH=_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绿原酸是从金银花中提取出的有很高药用价值的有机物,其结构如图所示,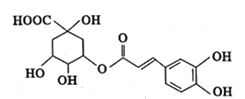
下列说法正确的是
A. 绿原酸的分子式为C16H20O9
B. 绿原酸分子中有4种含氧官能团
C. l mol绿原酸与NaOH溶液反应,可消耗7 mol NaOH
D. 绿原酸在酸性条件下的水解产物均能与NaHCO3发生反应生成CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)O基态原子核外电子排布式为____。H2O VSEPR模型名称为_____,立体构型为___。O3____极性分子(填“是”或“不是”)。
(2)利用热化学法来测定晶格能是由Born与Haber首先提出来的,其实质是利用Hess定律,构成一个热化学循环。
已知:Na(s)+ ![]() Cl2(g)= NaCl(s) ΔH=-410.9 kJ·mol-1
Cl2(g)= NaCl(s) ΔH=-410.9 kJ·mol-1
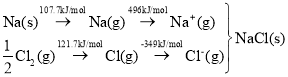
可知,Na原子的第一电离能为_____kJ·mol-1;Cl-Cl键键能为______kJ·mol-1;NaCl晶格能为_____kJ·mol-1。
(3)高压下NaCl 晶体和 Na 或 Cl2 反应,可以形成不同组成、不同结构的晶体,如图是其中一种晶体的晶胞(大球为氯原子, 小球为钠原子),其化学式为________。
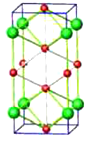
(4)金属Na晶体中的原子堆积方式称为体心立方堆积,晶胞参数为a nm,空间利用率为________(列出计算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】生产上用过量烧碱溶液处理某矿物(含Al2O3、MgO),过滤后得到的滤液用 NaHCO3溶液处理,测得溶液的pH和Al(OH)3生成的量随加入NaHCO3溶液体积变化的曲线如下图所示。下列有关说法错误的是
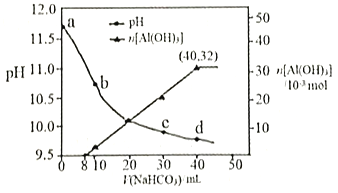
A. a点溶液中存在:c(Na+)+c(H+)=c(AlO2-)+c(OH-)
B. 水的电离程度:a点小于c点
C. 原 NaHCO3溶液中c(H2CO3)+c(HCO3-)+c(CO32-)=0.8mol·L-1
D. 生成沉淀的离子方程式为HCO3-+AlO2-+H2O=Al(OH)3↓+CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚氯酸钠是一种高效氧化剂漂白剂,主要用于棉纺、亚麻、纸浆等漂白。NaClO2在溶液中可生成ClO2、HClO2、ClO2-、Cl-等四种含氯微粒,经测定,25℃时各组分含量随pH变化情况如图所示(Cl-没有画出)。则下列分析不正确的是
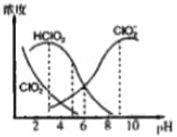
A. 亚氯酸钠在碱性条件下较稳定
B. 25℃时,HClO2的电离平衡常数的数值Ka=10-6
C. 25℃,pH=3时NaClO2溶液中c(Na+)+c(H+)=c(ClO2-)+c(OH-)
D. 若浓度均为0.1mol/L的HClO2溶液和NaClO2溶液等体积混合后所得溶液显酸性,溶液中有关微粒的浓度由大到小的顺序为c(ClO2-)>c(Na+)>c(HClO2)>c(H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以红土镍矿(主要含有Fe2O3、FeO、NiO、SiO2等)为原料,获取净水剂黄钠铁矾[NaFe(SO4)2(OH)6]和纳米镍粉的部分工艺流程如下:
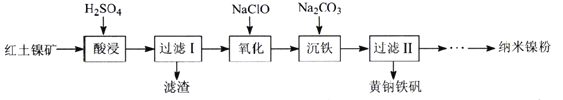
(1)“酸浸”过程,为提高铁和镍元素的浸出率,可采取的措施有___________(写出两种)。
(2)“过滤Ⅰ”滤渣的主要成分是______。
(3)“氧化”过程欲使0.3molFe2+转变为Fe3+,则需氧化剂NaClO至少为________ mol。
(4)“沉铁”过程中加入碳酸钠调节浴液的pH至2,生成黃钠铁矾沉淀,写出该反应的化学方程式______。若碳酸钠过多会导致生成的沉淀由黄钠铁矾转变为_____(填化学式)。
(5)向“过滤Ⅱ”所得滤液(富含Ni2+)中加入N2H4·H2O,在不同浓度的氢氧化钠溶液中反应,含镍产物的XRD图谱如下图所示(XRD图谱可用于判断某晶态物质是否存在,不同晶态物质出现衍射峰的衍射角不同)。欲制得高纯纳米镍粉最适宜的NaOH的物质的量浓度为_____。写出该条件下制备纳米镍粉同时生成N2的离子方程式_____。

(6)高铁酸盐也是一种优良的含铁净水剂,J.C.Poggendor早在1841年利用纯铁作电极插入浓的NaOH溶液电解制得Na2FeO4,阳极生成FeO42-的电极反应式为______;Deininger等对其进行改进,在阴、阳电极间设置阳离子交换膜,有效提高了产率,阳离子交换膜的作用是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W为短周期元素,若W原子的最外层电子数是其内层电子的![]() ,如图所示,下列说法不正确的是
,如图所示,下列说法不正确的是
X | Y | |
Z | W |
A.X元素的氢化物分子间可以形成氢键
B.Y元素的两种同素异形体常温下都是气体
C.阴离子半径从大到小的顺序为X>Y>Z>W
D.最高价氧化物对应的水化物的酸性:W>Z
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com