
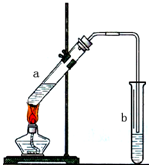
 用如图示装置制取少量乙酸乙酯.已知乙酸乙酯的沸点低于乙醇.请填空:
用如图示装置制取少量乙酸乙酯.已知乙酸乙酯的沸点低于乙醇.请填空:分析 a种乙醇和乙酸在浓硫酸作用下发生酯化反应生成乙酸乙酯,实验时应先加乙醇,后加浓硫酸,最后加乙酸,试管b中碳酸钠溶液可吸收乙醇、除去乙酸,降低乙酸乙酯的溶解度,加热可加快反应速率,长导管可冷凝回流,充分利用原料,以此来解答.
解答 解:(1)试管a中需要加入浓硫酸、冰醋酸和乙醇各2mL,正确的加入顺序及操作是先加入乙醇,然后边摇动试管边慢慢加入浓硫酸,最后再加入冰醋酸,
故答案为:先加入乙醇,然后边摇动试管边慢慢加入浓硫酸,最后再加入冰醋酸;
(2)液体乙酸乙醇沸点低,加热要加碎瓷片,防止暴沸,
故答案为:在试管a中加入几粒沸石(或碎瓷片);
(3)乙酸与乙醇在浓硫酸作用下加热发生酯化反应生成乙酸乙酯和水,该反应为可逆反应为:CH3COOH+C2H5OH$?_{△}^{浓硫酸}$CH3COOC2H5+H2O,
故答案为:CH3COOH+C2H5OH$?_{△}^{浓硫酸}$CH3COOC2H5+H2O;酯化反应;
(4)制备乙酸乙酯时常用饱和碳酸钠溶液,目的是中和挥发出来的乙酸,使之转化为乙酸钠溶于水中;溶解挥发出来的乙醇;降低乙酸乙酯在水中的溶解度,便于分层得到酯,
故答案为:吸收随乙酸乙酯蒸出的少量酸性物质和乙醇;
(5)导管伸入饱和碳酸钠溶液中,由于乙酸和乙醇溶于饱和碳酸钠溶液,导致装置内压强急剧降低,外界大气压压着液体进入,产生倒吸现象;
故答案为;防止发生倒吸.
点评 本题考查有机物的制备实验,为高频考点,把握制备实验操作、混合物分离提纯、有机物的性质为解答的关键,侧重分析与实验能力的考查,注意实验安全的分析,题目难度不大.


 中考解读考点精练系列答案
中考解读考点精练系列答案 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 用明矾净化饮用水 | |
| B. | 用石膏或盐卤点制豆腐 | |
| C. | 在CuSO4溶液中逐滴加入烧碱溶液出现蓝色沉淀 | |
| D. | 用手电筒照向夜空中会出现一条光柱 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
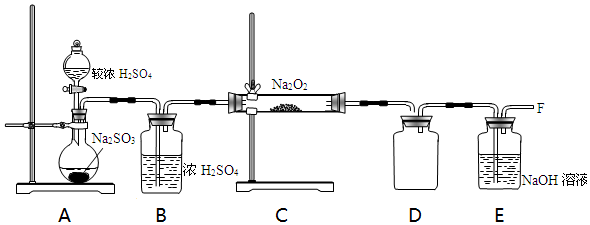
| 实验步骤 | 实验现象 | 实验结论 |
| 取少量吸收液于试管中滴加BaCl2溶液至过量 | 白色浑浊 | 吸收液中存在SO32-和SO42- |
| 取步骤I中白色沉淀于试管中,加入过量的稀盐酸 | 固体部分溶解,产生气泡 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | a+b+c=0 | B. | c=2a | C. | a>b | D. | c=a+b |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
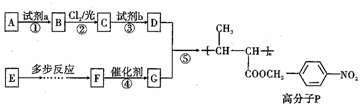
 ,试剂a是浓硫酸和浓硝酸.
,试剂a是浓硫酸和浓硝酸. +NaOH$→_{△}^{H_{2}O}$
+NaOH$→_{△}^{H_{2}O}$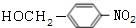 +NaCl.
+NaCl.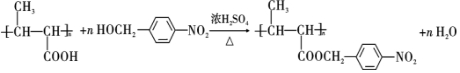 .
.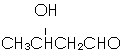 ,以E为起始原料.选用必要的无机试剂合成F,写出合成路线
,以E为起始原料.选用必要的无机试剂合成F,写出合成路线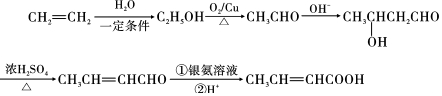 (用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件).
(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.2mol/L的NaHCO3溶液中:c(Na+)>c(HCO3-)>c(OH-)>c(H+)>c(CO32-) | |
| B. | 常温下,将等体积pH=4的盐酸和醋酸稀释成pH=5的溶液,盐酸需加的水多 | |
| C. | 常温下,向氨水中逐滴滴入盐酸至溶液的pH=7,则混合液中:c(NH4+)=c(Cl-) | |
| D. | pH=1的NaHSO4溶液:c(H+)=c(SO42-)+c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
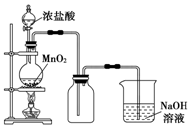 实验室中常用MnO2氧化浓盐酸的方法制取氯气,实验装置如图所示:
实验室中常用MnO2氧化浓盐酸的方法制取氯气,实验装置如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
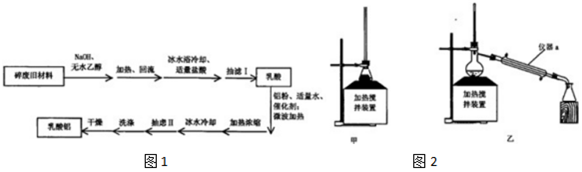
 $→_{②HCl}^{①NaOH}$CH3CH(OH)COOH$\stackrel{Al}{→}$Al[CH3CH(OH)COO]3
$→_{②HCl}^{①NaOH}$CH3CH(OH)COOH$\stackrel{Al}{→}$Al[CH3CH(OH)COO]3| 编号 | 时间/h | n(乳酸):n(铝) | ?(乳酸) | 产率(%) | 编号 | 时间/h | n(乳酸):n(铝) | ?(乳酸) | 产率(%) |
| 1 | 8 | 3.025 | 0.10 | 64.0 | 4 | 10 | 2.935 | 0.20 | 78.4 |
| 2 | 8 | 3.025 | 0.20 | 72.0 | 5 | 10 | 3.025 | 0.20 | 90.2 |
| 3 | 8 | 3.025 | 0.30 | 68.5 | 6 | 10 | 3.505 | 0.20 | 91.3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com