
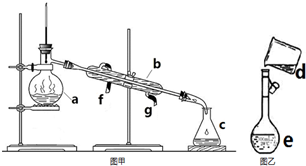
 掌握仪器名称、组装及使用方法是中学化学实验的基础,如图为两套实验装置.
掌握仪器名称、组装及使用方法是中学化学实验的基础,如图为两套实验装置.| 1000ρω |
| M |
| n |
| V |
| 1000×1.84×98% |
| 98 |
| n |
| V |
| n |
| V |


科目:高中化学 来源: 题型:
| A、做“钠与水的反应”实验时,切取绿豆大小的金属钠,用滤纸吸干其表面的煤油,放入烧杯中,滴入两滴酚酞溶液,再加入少量水,然后观察并记录实验现象 |
| B、单晶硅是将太阳能转变为电能的常用材料 |
| C、二氧化硫、氮氧化物、总悬浮颗粒物属于大气监测,空气质量日报的内容 |
| D、一旦金属汞洒落,必须尽可能收集起来,放在水中保存以防挥发;并将硫磺粉撒在洒落的地方,使金属汞转变成不挥发的硫化汞 |
查看答案和解析>>
科目:高中化学 来源: 题型:
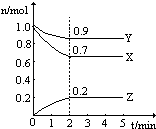 温度一定,在一个10L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.试根据图中数据,填写下列空白:
温度一定,在一个10L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.试根据图中数据,填写下列空白:查看答案和解析>>
科目:高中化学 来源: 题型:
| A | ||
| B | C |
查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)在298K时,1mol C2H6在氧气中完全燃烧生成CO2和液态水,放出热量1558.3kJ.写出该反应的热化学方程式
(1)在298K时,1mol C2H6在氧气中完全燃烧生成CO2和液态水,放出热量1558.3kJ.写出该反应的热化学方程式查看答案和解析>>
科目:高中化学 来源: 题型:
| 编号 | 实验操作 | 预期现象和结论 |
| 步骤① | 取少量待测液于试管A中,滴加2mol?L-1HCl至溶液呈酸性,加入几滴 | 证明待测液中含SO32-. |
| 步骤② | 有白色沉淀生成, 证明待测液中含SO42-. | |
| 步骤③ | 另取少量待测液于试管C中,加入足量氯水,再加入四氯化碳,振荡,静置后观察颜色. |
查看答案和解析>>
科目:高中化学 来源: 题型:
 一定温度下,在2L密闭容器中NO2和O2可发生下列反应:4NO2(g)+O2(g)?2N2O5(g)+5286kJ已知体系中n(NO2)随时间变化如下表:
一定温度下,在2L密闭容器中NO2和O2可发生下列反应:4NO2(g)+O2(g)?2N2O5(g)+5286kJ已知体系中n(NO2)随时间变化如下表:| t(s) | 0 | 500 | 1000 | 1500 |
| n(NO2)(mol) | 20 | 13.96 | 10.08 | 10.08 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A | C | |
| B |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在KI溶液中I2的溶解度增大是由于生成I3-离子 |
| B、I3-在溶液中存在下列平衡:I3-?I2+I- |
| C、KI3溶液遇淀粉溶液不呈蓝色 |
| D、将Cl2通入KI3溶液中,I3-浓度减小 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com