
分析 有X、Y、Z三种元素,它们的单质在常温、常压下皆为气体.X单质可在Z单质中燃烧,生成XZ,火焰为苍白色,其火焰为苍白色,细铁丝能在Z2中剧烈燃烧,且产生棕褐色烟,则X单质为H2,Z单质为Cl2,YZ为HCl;2molX2分子可与1molY2分子化合生成2molX2Y分子,X2Y在常温下为液体,说明Y单质为O2,X2Y为H2O,Cl2溶于H2O中,反应生成HCl和HClO,HClO具有漂白作用,以此解答该题.
解答 解:有X、Y、Z三种元素,它们的单质在常温、常压下皆为气体.X单质可在Z单质中燃烧,生成XZ,火焰为苍白色,其火焰为苍白色,细铁丝能在Z2中剧烈燃烧,且产生棕褐色烟,则X单质为H2,Z单质为Cl2,YZ为HCl;2molX2分子可与1molY2分子化合生成2molX2Y分子,X2Y在常温下为液体,说明Y单质为O2,X2Y为H2O,Cl2溶于H2O中,反应生成HCl和HClO,HClO具有漂白作用.
(1)由上述分析可知,X为氢元素、Y为氧气、Z为氯元素,故答案为:氢;氧;氯;
(2)④化学反应方程式为:Cl2+H2O?HCl+HClO,
⑤的化学反应方程式为:2Fe+3Cl2$\frac{\underline{\;点燃\;}}{\;}$2FeCl3,
故答案为:Cl2+H2O?HCl+HClO;2Fe+3Cl2$\frac{\underline{\;点燃\;}}{\;}$2FeCl3.
点评 本题考查无机物的推断,侧重于学生的分析能力的考查,根据物质的颜色、状态、反应现象等为推断的突破口,学习中注意相关基础知识的积累.


科目:高中化学 来源: 题型:解答题
 2SO2(g)+O2(g)?2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3(g)的△H=-99kJ•mol-1.
2SO2(g)+O2(g)?2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3(g)的△H=-99kJ•mol-1.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 气态氢化物的稳定性:X<Z<W | |
| B. | X、Z、W氧化物对应水化物酸性的强弱顺序为X<Z<W | |
| C. | Y的阳离子半径比W的阴离子半径小 | |
| D. | 室温下,含Y元素的盐形成的水溶液其pH<7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.3Na与O2完全反应生成3.6g产物时失去电子数为0.1NA | |
| B. | 电解精炼铜时,当电路中转移NA个电子,阳极溶解32g铜 | |
| C. | 标准状况下,11.2LSO3中所含原子数为2NA | |
| D. | 5.6g铁粉与稀硝酸反应失去的电子数一定为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醇既可以发生催化氧化反应,又可以发生酯化反应 | |
| B. | 用溴水可以鉴别乙醇、乙酸和苯 | |
| C. | 糖类、油脂、蛋白质三类物质都只含有C、H、O三种元素 | |
| D. | C5H10O属于醛类的同分异构体为六种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 某同学将电解池工作时电子、离子流动方向及电极种类等信息表示在如图中,下列有关分析完全正确的是
某同学将电解池工作时电子、离子流动方向及电极种类等信息表示在如图中,下列有关分析完全正确的是| A | B | C | D | |
| a电极 | 阳极 | 阴极 | 阳极 | 阴极 |
| d电极 | 正极 | 正极 | 负极 | 负极 |
| Q离子 | 阳离子 | 阳离子 | 阴离子 | 阴离子 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
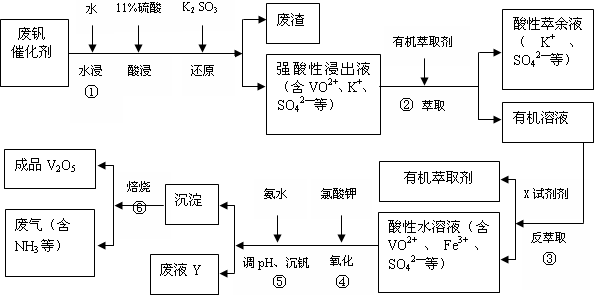
| pH | 1.3 | 1.4 | 1.5 | 1.6 | 1.7 | 1.8 | 1.9 | 2.0 | 2.1 |
| 钒沉淀率/% | 88.1 | 94.8 | 96.5 | 98.0 | 98.8 | 98.8 | 96.4 | 93.1 | 89.3 |
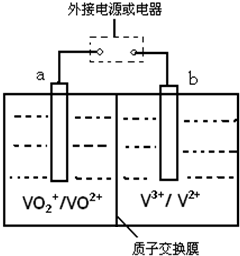
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com