
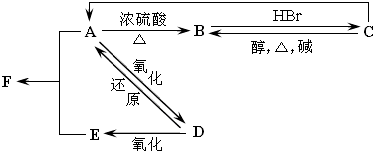
分析 (1)反应中NaBiO3→Bi2(SO4)3,Bi元素化合价由+5价降低为+3价,共降低4价,MnSO4→NaMnO4,Mn元素化合价由+2价升高为+7价,共升高5价,化合价升降最小公倍数为20,故Bi2(SO4)3系数为5,MnSO4系数为4,根据元素守恒判断其它物质的系数,配平反应的化学方程式;
(2)化合价降低的元素所在的反应物是氧化剂,化合价升高元素所在的物质被氧化;
(3)根据反应中的电子守恒知识来计算;
(4)NaBiO3固体溶于盐酸时发生反应生成氯气、氯化钠、氯化铋水溶液,据此书写离子方程式.
解答 解:(1)反应中NaBiO3→Bi2(SO4)3,Bi元素化合价由+5价降低为+3价,共降低4价,MnSO4→NaMnO4,Mn元素化合价由+2价升高为+7价,共升高5价,化合价升降最小公倍数为20,故Bi2(SO4)3系数为5,MnSO4系数为4,根据元素守恒可知,NaBiO3的系数为10,NaMnO4系数为4,根据钠元素守恒可知Na2SO4的系数为3,根据硫酸根守恒可知H2SO4的系数为14,根据氢元素守恒可知H2O的系数为14,配平反应的化学方程式为:10NaBiO3+4MnSO4+14H2SO4=3Na2SO4+5Bi2(SO4)3+4NaMnO4+14H2O;故答案为:10;4;14;3;5;4;14;
(2)化合价降低的元素所在的反应物NaBiO3是氧化剂,化合价升高元素+2价的Mn被氧化,故答案为:NaBiO3;+2价的Mn;
(3)根据反应:10NaBiO3+4MnSO4+14H2SO4=3Na2SO4+5Bi2(SO4)3+4NaMnO4+14H2O;若有2mol氧化剂NaBiO3在上述反应中被还原,则生成0.8mol的MnO4-,0.8mol高锰酸根离子被还原为Mn2+时,转移电子是4mol,根据电子守恒,能将4molHCl氧化成Cl2,故答案为:4;
(4)NaBiO3固体溶于盐酸时发生反应生成氯气、氯化钠、氯化铋,即NaBiO3+6H++2Cl-=Na++Bi3++Cl2↑+3H2O.
故答案为:NaBiO3+6H++2Cl-=Na++Bi3++Cl2↑+3H2O.
点评 本题考查了氧化性强弱的判断、氧化还原反应的配平、计算以及离子方程式的书写等,难度中等,关键是掌握氧化还原反应的配平方法.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NO2、SO2、BF3、NCl3分子中没有一个分子中原子的最外层电子都满足了8e-稳定结构 | |
| B. | P4和CH4都是正四面体分子且键角都为109°28′ | |
| C. | NaCl晶体中与每个Na+距离相等且最近Na+共有12个 | |
| D. | CsCl晶体中与每个Cs+距离相等且最近Cl-共有6个 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 75%的酒精溶液 | B. | 硝酸钠 | C. | 碱石灰 | D. | 豆浆 | ||||
| E. | 过氧化钠 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 自然界中不存在游离态的硫,且S可溶于CS2 | |
| B. | SO2和SO3都是酸性氧化物,二者的水溶液都是强酸 | |
| C. | 浓硫酸可用来干燥SO2、CO、Cl2等气体 | |
| D. | 将铜片放入浓硫酸中,无明显现象是因为铜片发生了钝化 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | c=$\frac{W1000ρ}{M}$ | B. | m=$\frac{VρW}{100}$ | C. | W%=$\frac{CM}{1000ρ}$% | D. | c=$\frac{1000m}{VM}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铝粉投入到NaOH溶液中:2Al+2OH-═2AlO2-+H2↑ | |
| B. | AlCl3溶液中加入足量的氨水:Al3++3OH-═Al(OH)3↓ | |
| C. | 碳酸氢钠溶液中滴加氢氧化钠溶液:HCO3-+OH-═CO2+H2O | |
| D. | 过氧化钠与水的反应:2Na2O2+2H2O═4Na++4OH-+O2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com