
| A. | NaF | B. | CaO | C. | K2S | D. | MgS |
分析 素最高正价与负价的绝对值之差为4,根据最高正价+|最低负价|=8,可知该元素最高正价为+6,形成离子应为S元素,硫离子核外有18个电子,所以另一离子应含有18个电子,以此解答该题.
解答 解:解:元素最高正价与最低负价的绝对值之差是4,
令该元素最高正价为x,根据最高正价+|最低负价|=8,则:
x-(8-x)=4,解得x=6,
即该元素最高正价为+6,形成离子应为S元素,硫离子核外有18个电子,该元素的离子与另外离子核外电子排布相同的离子,则另一离子应含有18个电子,为阳离子.故C符合.
故选C.
点评 本题考查元素的推断与物质的组成,为高频考点,侧重于学生的分析能力的考查,推出元素为S元素是解答本题的关键,学生应学会利用原子结构来推断元素.


科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同主族元素的原子半径越大,熔点越高 | |
| B. | 在元素周期表中,s区,d区和ds区的元素都是金属 | |
| C. | 石墨晶体中的作用力有共价键、金属键两种,是一种混合晶体 | |
| D. | 在晶体中只要有阴离子就一定有阳离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4+、K+、SO42-、Br- | B. | K+、Na+、AlO2-、Cl- | ||
| C. | Fe3+、K+、SO42-、NO3- | D. | K+、Na+、NO3-、I- |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
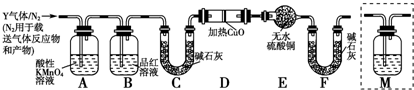
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com