
分析 I.A.乙烯(C2H4)中含极性和非极性键;
B.醋酸钠中含离子键和极性键;
C.氯化铵中含离子键和极性键;
D.干冰中含极性键;
E.苛性钠中含离子键和极性键;
F.食盐中只含离子键;
G.C60 中只含非极性键;
H.氩气不含化学键;
I.过氧化钠中含离子键和非极性键;
J.双氧水中含极性键和非极性键;
II.(1)根据电池反应式知,锌失电子发生氧化反应而作负极,氧气在正极得电子发生还原反应,根据电极反应式计算;
(2)a.将铜片和石墨用导线连接后插入三氯化铁溶液中,能构成原电池,负极是活泼金属铜失去电子,电极反应式为Cu-2e-═Cu2+;
b.相当于是锌置换出银,由2AgNO3+Zn=Zn(NO3)2+2Ag可知Zn溶解而Ag片上有Ag析出,溶液由AgNO3→Zn(NO3)2质量减轻;
c.镁条和铝片为电极,并用导线连接同时插入NaOH溶液中,铝与电解质溶液发生自发的氧化还原反应,镁条是正极,所以镁条表面产生气泡;
d.铜片和铝片为电极,并用导线连接同时插入浓硝酸溶液中,铝发生钝化,所以铜片为负极.
解答 解:I.A.乙烯(C2H4)中含极性和非极性键;
B.醋酸钠中含离子键和极性键;
C.氯化铵中含离子键和极性键;
D.干冰中含极性键;
E.苛性钠中含离子键和极性键;
F.食盐中只含离子键;
G.C60 中只含非极性键;
H.氩气不含化学键;
I.过氧化钠中含离子键和非极性键;
J.双氧水中含极性键和非极性键;
(1)只含非极性键的是:G; (2)只含极性键和非极性键的是:A J; (3)只含离子键和极性键的是:C E; (4)只含离子键和非极性键的是:I; (5)同时含有离子键、非极性键和极性键的是:B;
故答案为:G;AJ;CE;I;B;
II.(1)根据电池反应式知,锌失电子发生氧化反应,所以锌作负极,电极反应式为:2Zn-4e-═2Zn2+,氧气在正极得电子发生还原反应,电极反应式为:O2+4H++4e-═2H2O,若电池工作过程中有5.6L O2(标准状况下)即$\frac{5.6L}{22.4L/mol}$=0.25mol参于反应,则转移电子的物质的量为0.25mol×4=1mol;
故答案为:2Zn-4e-═2Zn2+;1mol;
(2)a.将铜片和石墨用导线连接后插入三氯化铁溶液中,能构成原电池,负极是活泼金属铜失去电子,电极反应式为Cu-2e-═Cu2+,故正确;
b.相当于是锌置换出银,由2AgNO3+Zn=Zn(NO3)2+2Ag可知Zn溶解而Ag片上有Ag析出,溶液由AgNO3→Zn(NO3)2质量减轻,故正确;
c.镁条和铝片为电极,并用导线连接同时插入NaOH溶液中,铝与电解质溶液发生自发的氧化还原反应,镁条是正极,所以镁条表面产生气泡,故正确;
d.铜片和铝片为电极,并用导线连接同时插入浓硝酸溶液中,铝发生钝化,所以铜片为负极,故正确;
故答案为:abcd.
点评 本题是化学键和电化学知识的考查,难度不是很大,主要是考查学生对原电池原理的熟悉掌握程度,特别是电极反应式的判断,有利于提高学生的学习效率.


科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
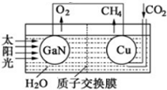 氮化镓是目前最热门的半导体材料,应用前景非常广阔.已有科学家用氮化镓材料与铜组装如图的人工光合系统,利用该装置成功地实现了以CO2和H2O合成CH4,装置如图所示,回答下列问题:
氮化镓是目前最热门的半导体材料,应用前景非常广阔.已有科学家用氮化镓材料与铜组装如图的人工光合系统,利用该装置成功地实现了以CO2和H2O合成CH4,装置如图所示,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | Y与W可以组成YW32-、Y2W42- | |
| B. | 由X、Y、Z、W四种元素组成的既能与酸又能与碱反应的化合物,一定属于α-氨基酸 | |
| C. | 若化合物Y2X4W2能发生银镜反应,则该化合物一定是甲酸甲酯 | |
| D. | 混合物Y7X8、Y3 X8W3中X的质量分数约为8.7% |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
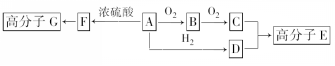
 .
. +2H2O.
+2H2O.查看答案和解析>>
科目:高中化学 来源: 题型:推断题

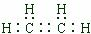 ;B中含官能团名称是羟基.
;B中含官能团名称是羟基.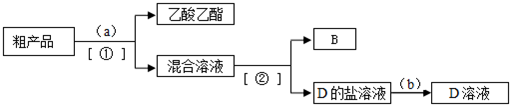
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 元素代号 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
| 原子半径(nm) | 0.186 | 0.160 | 0.152 | 0.143 | 0.110 | 0.099 | 0.075 | 0.074 |
| 主要化合价 | +1 | +2 | +1 | +3 | +5、-3 | +7、-1 | +5、-3 | -2 |
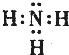 ,稳定性最强的氢化物的结构式为H-O-H;
,稳定性最强的氢化物的结构式为H-O-H; .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
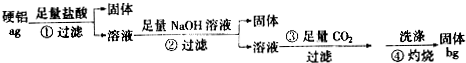
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 海洋约占地球表面积的71%,所以地球上不缺水 | |
| B. | 海水淡化蒸馏法的成本最低 | |
| C. | 海水淡化的主要方法有蒸馏法、电渗析法和离子交换法等 | |
| D. | 以上说法都正确 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com