
| 实验步骤与结论: |
分析 (1)V2O5能够与NaOH反应生成偏钒酸钠和水;
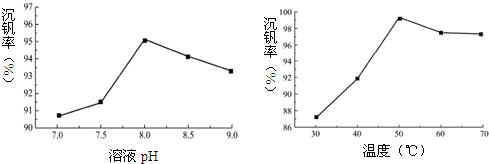
(2)据图分析提高沉钒率的pH,随温度升高沉钒率增大,说明生成偏钒酸铵沉淀的反应是吸热反应;
(3)提高沉钒率的其他因素除氯化铵溶液的浓度外偏钒酸钠溶液浓度也可能有影响;
(4)作对比实验判断氯化铵溶液的浓度对沉钒率的影响;
(5)偏钒酸铵灼烧产生五氧化二钒,元素化合价没有变化,据原子守恒书写化学方程式.
解答 解:(1)V2O5与NaOH反应生成偏钒酸钠和水,反应的离子方程式为:V2O5+2OH-=2VO3-+H2O,故答案为:V2O5+2OH-=2VO3-+H2O;
(2)据图可知,pH=8时,沉钒率最高,随温度升高沉钒率增大,说明生成偏钒酸铵沉淀的反应是吸热反应,故答案为:8.0;吸热;
(3)提高沉钒率的其他因素除氯化铵溶液的浓度外偏钒酸钠溶液浓度也可能有影响,故答案为:偏钒酸钠溶液浓度;
(4)探究氯化铵溶液的浓度对沉钒率的影响,应使其他条件相同,氯化铵溶液的浓度不同,再使用专用仪器测定计算沉钒率,据若两份溶液沉钒率判断,具体步骤为
①取等体积0.5 mol/L的偏钒酸钠溶液,分别加入不同体积1 mol/L的氯化铵溶液,加入蒸馏水使两份溶液总体积相等,
②控制两份溶液温度均为50℃,pH均为8,
③使用专用仪器测定计算沉钒率,
若两份溶液沉钒率不同,则假设一成立.反之则不成立,
故答案为:①取等体积0.5 mol/L的偏钒酸钠溶液,分别加入不同体积1 mol/L的氯化铵溶液,加入蒸馏水使两份溶液总体积相等,
②控制两份溶液温度均为50℃,pH均为8,
③使用专用仪器测定计算沉钒率,
若两份溶液沉钒率不同,则假设一成立.反之则不成立;
(5)偏钒酸铵灼烧产生五氧化二钒,同时生成氨气和水蒸气,反应方程式为2NH4VO3 $\frac{\underline{\;△\;}}{\;}$2NH3↑+H2O↑+V2O5,故答案为:2NH4VO3 $\frac{\underline{\;△\;}}{\;}$2NH3↑+H2O↑+V2O5.
点评 本题通过模拟生产V2O5工艺流程考查了化学方程式书写、离子方程式书写、探究物质性质的方法和程序、图象分析,题目难度较大.


科目:高中化学 来源: 题型:选择题
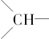 ),并且乙烯基和次甲基之间必须通过亚甲基相连.当该烃含有单环结构时,分子中的乙烯基和亚甲基数依次为( )
),并且乙烯基和次甲基之间必须通过亚甲基相连.当该烃含有单环结构时,分子中的乙烯基和亚甲基数依次为( )| A. | 4、6 | B. | 2、3 | C. | 3、6 | D. | 3、3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ③④ | C. | ①②③ | D. | ①③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
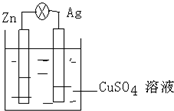 (1)在银锌原电池中,以硫酸铜为电解质溶液,锌为负极,电极上发生的是氧化反应(“氧化”或“还原”).电极反应式为Zn-2e-═Zn2+.
(1)在银锌原电池中,以硫酸铜为电解质溶液,锌为负极,电极上发生的是氧化反应(“氧化”或“还原”).电极反应式为Zn-2e-═Zn2+.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子化合物中不含共价键 | |
| B. | 共价化合物中不含离子键 | |
| C. | 非金属元素组成的化合物一定是共价化合物 | |
| D. | 非极性键不是化学键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
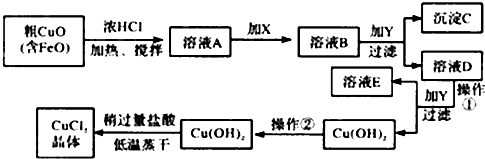
| 物 质 | Fe(OH)2 | Cu(OH)2 | Fe(OH)3 |
| 完全沉淀时的pH范围 | ≥9.6 | ≥6.4 | 3~4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CCl4可由CH4反应得到,可萃取碘水中的碘 | |
| B. | 石油和天然气的主要成分都是碳氢化合物 | |
| C. | 乙醇、乙酸和乙酸乙酯能用饱和Na2CO3溶液鉴别 | |
| D. | 证明CH3CH2CH=CHCH2CHO分子中有碳碳不饱和键的方法:向其中加酸性高锰酸钾溶液,高锰酸钾溶液褪色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com