
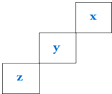
| A. | 元素Z一定是长周期元素,且既有金属性又有非金属性 | |
| B. | 三种元素中X元素的最高价氧化物对应的水化物酸性最强 | |
| C. | 三种元素中X元素的气态氢化物还原性最弱 | |
| D. | Y元素可形成多种不同的单质 |
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案科目:高中化学 来源: 题型:解答题
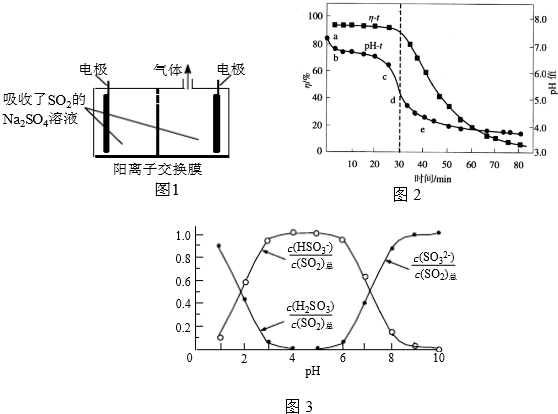
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
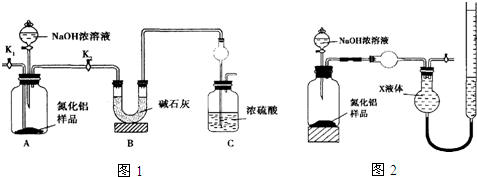
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
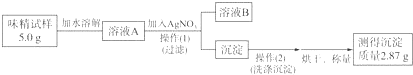
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
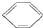
| A. | 醛基的电子式 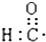 | B. | 丙烷的分子结构的比例模型: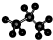 | ||
| C. | 乙烯的最简式(实验式):CH2 | D. | 硝基苯的结构简式: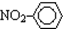 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
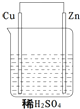 关于如图所示的原电池下列叙述正确的是( )
关于如图所示的原电池下列叙述正确的是( )| A. | ①②③ | B. | ④⑤⑥ | C. | ①③⑤ | D. | ②④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
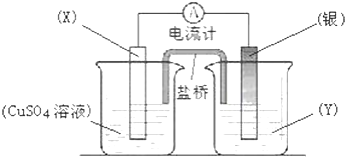
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 产物B的状态只能为固态或液态 | |
| B. | 平衡时,单位时间内c(A)消耗﹕c(C)消耗=1﹕1 | |
| C. | 保持体积不变,向平衡体系中加入B,平衡可能向逆反应方向移动 | |
| D. | 若开始时向容器中加入1molB和1molC,达到平衡时放出热量a kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
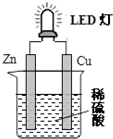
| A. | 如果将硫酸换成柠檬汁,导线中不会有电子流动 | |
| B. | 装置中存在“化学能→电能→光能”的转换 | |
| C. | 铜片表面有气泡生成 | |
| D. | 如果将锌片换成铁片,电路中的电流方向不变 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com