
【题目】苯乙烷(![]() -C2H5)可生产塑料单体苯乙烯(
-C2H5)可生产塑料单体苯乙烯(![]() -CH=CH2),其原理反应是:
-CH=CH2),其原理反应是:![]() -C2H5(g)
-C2H5(g) ![]()
![]() -CH=CH2(g) + H2(g);△H = +125 kJ·mol-1。某温度下,将0.40 mol
-CH=CH2(g) + H2(g);△H = +125 kJ·mol-1。某温度下,将0.40 mol![]() -C2H5(g)充入2L真空密闭容器中发生反应,测定该容器内的物质,得到数据如下表:
-C2H5(g)充入2L真空密闭容器中发生反应,测定该容器内的物质,得到数据如下表:
时间/min | 0 | 10 | 20 | 30 | 40 |
n( | 0.40 | 0.30 | 0.26 | n2 | n3 |
n( | 0.00 | 0.10 | n1 | 0.16 | 0.16 |
(1)n1=__________mol,计算该反应的平衡常数,K=___________。
(2)工业上常以高温水蒸气作为反应体系的稀释剂(不参与反应)。![]() -C2H5(g)的平衡转化率与水蒸气的用量、体系总压强的关系如图所示。当其它条件不变时,水蒸气的用量越大,平衡转化率将_________(填“越大”、“越小”或“不变”),原因是____________。
-C2H5(g)的平衡转化率与水蒸气的用量、体系总压强的关系如图所示。当其它条件不变时,水蒸气的用量越大,平衡转化率将_________(填“越大”、“越小”或“不变”),原因是____________。

(3)副产物H2用做氢氧燃料电池。写出酸性条件下,该电池正极的电极反应式__________。
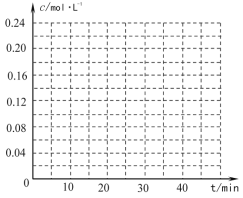
(4)在相同条件下,若最初向该容器中充入![]() -CH=CH2(g)和H2(g),假设在40min时达到上述同样的平衡状态,请在图中画出并标明该条件下
-CH=CH2(g)和H2(g),假设在40min时达到上述同样的平衡状态,请在图中画出并标明该条件下![]() -C2H5(g)和
-C2H5(g)和![]() -CH=CH2(g)的浓度c随时间t变化的曲线_____。
-CH=CH2(g)的浓度c随时间t变化的曲线_____。
【答案】 0.14 0.053 mol·L-1 越大 体系总压强一定时,水蒸气的分压越大,平衡体系的分压越小,平衡向气体体积增大的方向移动。或者:水蒸汽的用量增大,体系内各物质的浓度商QC小于平衡常数KC,所以平衡将向右移动,使苯乙烷的转化率增大 O2+ 4H+ + 4e- = 2H2O 
【解析】
(1)20min时,![]() -C2H5的物质的量为0.26mol,变化的物质的量为0.40mol-0.26mol=0.14mol,根据方程式
-C2H5的物质的量为0.26mol,变化的物质的量为0.40mol-0.26mol=0.14mol,根据方程式![]() -C2H5(g)
-C2H5(g)![]()
![]() -CH=CH2(g)+H2(g)可知,生成
-CH=CH2(g)+H2(g)可知,生成![]() -CH=CH20.14mol,
-CH=CH20.14mol,
![]() -C2H5(g)
-C2H5(g)![]()
![]() -CH=CH2(g)+H2(g)
-CH=CH2(g)+H2(g)
起始:0.40mol 0 0
转化:0.16mol 0.16mol 0.16mol
平衡:0.24mol 0.16mol 0.16mol
平衡时:c(![]() -C2H5)=0.12mol/L,c(
-C2H5)=0.12mol/L,c(![]() -CH=CH2)=0.08mol/L,c(H2)=0.08mol/L,
-CH=CH2)=0.08mol/L,c(H2)=0.08mol/L,
k=![]() =0.053molL-1,故答案为:0.14;0.053molL-1;
=0.053molL-1,故答案为:0.14;0.053molL-1;
(2)由化学方程式可知,增大压强,平衡向逆反应方向移动,则体系总压强一定时,水蒸气的分压越大,平衡体系的分压越小,平衡向气体体积增大的方向移动,所以转化率增大,故答案为:越大;体系总压强一定时,水蒸气的分压越大,平衡体系的分压越小,平衡向气体体积增大的方向移动;
(3)酸性氢氧燃料电池中,正极上氧气得电子发生还原反应,反应的电极方程式为O2+4H++4e-=2H2O,故答案为:O2+4H++4e-=2H2O;
(4)在相同条件下,若最初向该容器中充入![]() -CH=CH2(g)和H2(g),假设在40min时达到上述同样的平衡状态,平衡时,c(
-CH=CH2(g)和H2(g),假设在40min时达到上述同样的平衡状态,平衡时,c(![]() -C2H5)=0.12mol/L,c(
-C2H5)=0.12mol/L,c(![]() -CH=CH2)=0.08mol/L,c(H2)=0.08mol/L,起点(0,0.20)、终点在(40,0.08);苯乙烷曲线变化趋势在增大,弓向浓度轴,且起点(0,0)、终点(40,0.12),则图像为
-CH=CH2)=0.08mol/L,c(H2)=0.08mol/L,起点(0,0.20)、终点在(40,0.08);苯乙烷曲线变化趋势在增大,弓向浓度轴,且起点(0,0)、终点(40,0.12),则图像为 ,故答案为:
,故答案为: 。
。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】在一个密闭容器中发生如下反应:2SO2(g)+O2(g)![]() 2SO3(g),反应过程中某一时刻测得SO2、O2、SO3的浓度分别为0.2mol·L-1,0.2 mol·L-1,0.2 mol·L-1,当反应达到平衡时,可能出现的数据是( )
2SO3(g),反应过程中某一时刻测得SO2、O2、SO3的浓度分别为0.2mol·L-1,0.2 mol·L-1,0.2 mol·L-1,当反应达到平衡时,可能出现的数据是( )
A. c(SO3)=0.4 mol·L-1B. c(SO2)=c(SO3)=0.15 mol·L-1
C. c(O2)=0.1 mol·L-1D. c(SO2)+c(SO3)=0.4 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上采用乙烯和水蒸气在催化剂(磷酸/硅藻土)表面合成乙醇,反应原理为CH2===CH2(g)+H2O(g) ![]() CH3CH2OH(g),副产物有乙醛、乙醚及乙烯的聚合物等。下图是乙烯的总转化率随温度、压强的变化关系,下列说法正确的是:
CH3CH2OH(g),副产物有乙醛、乙醚及乙烯的聚合物等。下图是乙烯的总转化率随温度、压强的变化关系,下列说法正确的是:
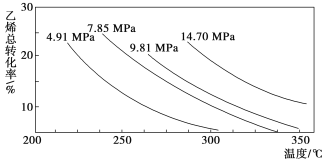
A. 合成乙醇的反应一定为吸热反应
B. 目前工业上采用250~300 ℃,主要是因为在此温度下乙烯的转化率最大
C. 目前工业上采用加压条件(7 MPa左右),目的是提高乙醇的产率和加快反应速率
D. 相同催化剂下,在300 ℃ 14.70 MPa乙醇产率反而比300 ℃ 7.85 MPa低得多,是因为加压平衡向逆反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设![]() 为阿伏加德罗常数值。下列有关叙述正确的是
为阿伏加德罗常数值。下列有关叙述正确的是
A. 1mol![]() 与4mol
与4mol![]() 反应生成的
反应生成的![]() 分子数为
分子数为![]()
B. 1molFe溶于过量硝酸,电子转移数为![]()
C. 14g乙烯和丙烯混合气体中的氢原子数为![]()
D. 标准状况下,2.24L![]() 含有的共价键数为0.4
含有的共价键数为0.4![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有①熔融的BaCl2、②H2SO4溶于水、③NH4Cl溶于水、④Na2O2溶液、⑤干冰升华、⑥溴水被CCl4萃取六种物质,按下列要求回答:
(1)化学键没有破坏的是__________,仅破坏共价键的是________,仅破坏离子键的是________,离子键和共价键都破坏的是_____________。
(2)NH4Cl的电子式是________,CO2的结构和CS2相似,请你写出CS2的电子式_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)某化学小组制备氢氧化铁胶体:在洁净的小烧杯中盛适量蒸馏水,用酒精灯加热至沸腾,向烧杯中逐滴加入饱和FeCl3溶液,至液体呈红褐色,停止加热。制备氢氧化铁胶体的化学反应方程式是________________________。
(2)如图所示是中学化学中常用于混合物分离和提纯的装置:
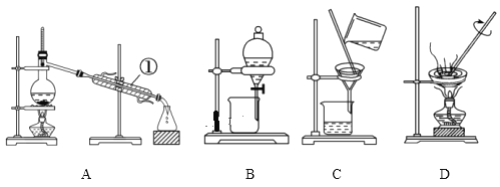
请根据装置图回答下列问题:
①从氯化钾溶液中得到氯化钾固体选择装置_________(填代表装置图的字母,下同);除去自来水中的Cl-等杂质得到蒸馏水选择装置_________;从碘水中提取碘选择装置_________。
②装置A中①的名称是____________,冷凝水流动的方向是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. ![]() 的名称为3-甲基丁烷
的名称为3-甲基丁烷
B. CH3CH2CH2CH2CH3和 ![]() 互为同素异形体
互为同素异形体
C. CH3CH2OH和 ![]() 具有相同的官能团,互为同系物
具有相同的官能团,互为同系物
D.  和
和  为同一物质
为同一物质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列有关说法不正确的是
A. 由1mol CH3OCOONa和少量CH3COOH形成的中性溶液中,CH3COO-数目是NA
B. 1.68gFe与足量高温水蒸气反应,转移电子的数目为0.09NA
C. 氢原子数为0.4NA的CH3OH 分子中含有的电子数为1.8NA
D. 常温下,2L 0.1molL-1FeCl3溶液与1L0.2molL-1FeCl3溶液所含Fe3+数目不同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com