
| 57 |
| 12 |
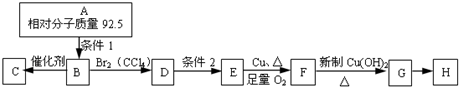
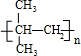 ,(CH3)2C=CH2与溴发生加成反应生成D为(CH3)2CBr-CH2Br,D转化得到E,E可以连续氧化生成G,应是D水解生成E,则E为(CH3)2C(OH)-CH2OH,F为(CH3)2C(OH)-CHO,F氧化生成G,则G为(CH3)2C(OH)-COOH,G发生成环酯化反应生成H,则H为
,(CH3)2C=CH2与溴发生加成反应生成D为(CH3)2CBr-CH2Br,D转化得到E,E可以连续氧化生成G,应是D水解生成E,则E为(CH3)2C(OH)-CH2OH,F为(CH3)2C(OH)-CHO,F氧化生成G,则G为(CH3)2C(OH)-COOH,G发生成环酯化反应生成H,则H为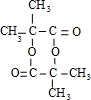 ,据此解答.
,据此解答.| 57 |
| 12 |
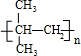 ,(CH3)2C=CH2与溴发生加成反应生成D为(CH3)2CBr-CH2Br,D转化得到E,E可以连续氧化生成G,应是D水解生成E,则E为(CH3)2C(OH)-CH2OH,F为(CH3)2C(OH)-CHO,F氧化生成G,则G为(CH3)2C(OH)-COOH,G发生成环酯化反应生成H,则H为
,(CH3)2C=CH2与溴发生加成反应生成D为(CH3)2CBr-CH2Br,D转化得到E,E可以连续氧化生成G,应是D水解生成E,则E为(CH3)2C(OH)-CH2OH,F为(CH3)2C(OH)-CHO,F氧化生成G,则G为(CH3)2C(OH)-COOH,G发生成环酯化反应生成H,则H为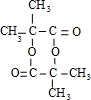 ;
;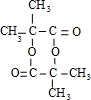 ,故答案为:(CH3)2C(OH)-CH2OH;
,故答案为:(CH3)2C(OH)-CH2OH;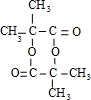 ;
;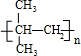 ,反应方程式为:n(CH3)2C=CH2
,反应方程式为:n(CH3)2C=CH2| 催化剂 |
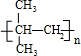 ,
,| △ |
| 催化剂 |
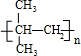 ,(CH3)2C(OH)-CHO+2Cu(OH)2+NaOH
,(CH3)2C(OH)-CHO+2Cu(OH)2+NaOH| △ |
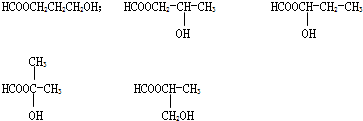 共5种,
共5种,

科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、11.7g |
| B、23.4 g |
| C、35.1g |
| D、58.5g |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com