
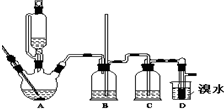
 实验室制备1,2二溴乙烷的反应原理如下:
实验室制备1,2二溴乙烷的反应原理如下:| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | -130 | 9 | -116 |
分析 用少量的溴和足量的乙醇、浓硫酸制备1,2-二溴乙烷,装置A中是浓硫酸、乙醇迅速加热到170°C,反应生成乙烯,乙烯中含有二氧化硫、二氧化碳、水蒸气,1,2-二溴乙烷熔点为9℃,冷却容易析出晶体,堵塞玻璃导管,B为安全瓶,可以防止倒吸,根据E中内外液面高低变化,可以判断是否发生堵塞,装置C浓硫酸具有强氧化性,将乙醇氧化成二氧化碳,自身被还原成二氧化硫,二氧化碳;生成的酸性气体为SO2、CO2可以和氢氧化钠反应,装置D是发生的反应是乙烯与溴发生加成反应生成1,2-二溴乙烷,1,2-二溴乙烷的凝固点较低(9℃),反应过程中应用冷水冷却装置D得到1,2-二溴乙烷,
(1)实验室制备1,2-二溴乙烷,先发生乙醇的消去反应生成乙烯,乙醇迅速加热到170°C,反应生成乙烯,乙醇在浓硫酸的存在下在140℃脱水生成乙醚;
(2)装置C中应为碱性溶液,吸收反应中可能生成的酸性气体;
(3)乙烯和溴水发生加成反应生成1,2-二溴乙烷,1,2-二溴乙烷为无色;
(4)将1,2-二溴乙烷粗产品置于分液漏斗中加水,密度为2.2g/ml,比水重;
(5)产物中溴单质和氢氧化钠溶液反应生成溶于水的溶液;
(6)1,2-二溴乙烷与乙醚的沸点不同,两者均为有机物,互溶,用蒸馏的方法将它们分离;
(7)溴易挥发,冷却防止溴大量挥发;1,2-二溴乙烷的凝固点较低(9℃),过度冷却会使其凝固而使气路堵塞.
解答 解:(1)实验室制备1,2-二溴乙烷的反应原理为:先发生乙醇的消去反应生成乙烯,反应分别为CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O、在此实验中,要迅速地把反应温度提高到170℃左右,乙醇在浓硫酸的存在下在140℃脱水生成乙醚,其最主要目的是:减少副产物乙醚生成,
故答案为:d;
(2)浓硫酸具有强氧化性,将乙醇氧化成二氧化碳,自身被还原成二氧化硫,二氧化碳、二氧化硫能和氢氧化钠溶液反应而被吸收,则装置C中试剂为NaOH溶液,其目的是吸收反应中可能生成的酸性气体,
故答案为:c;
(3)乙烯和溴水发生加成反应生成1,2-二溴乙烷,1,2-二溴乙烷为无色,D中溴颜色完全褪去说明反应已经结束,
故答案为:溴的颜色完全褪去;
(4)将1,2-二溴乙烷粗产品置于分液漏斗中加水,振荡后产物应在下层,
故答案为:下;
(5)若产物中有少量未反应的Br2,溴单质和氢氧化钠溶液反应,最好用氢氧化钠溶液洗涤除去,
故答案为:b;
(6)两者均为有机物,互溶,但1,2-二溴乙烷与乙醚的沸点不同,用蒸馏的方法将它们分离,
故答案为:蒸馏;
(5)溴在常温下,易挥发,乙烯与溴反应时放热,溴更易挥发,冷却可避免溴的大量挥发,但1,2-二溴乙烷的凝固点9℃较低,不能过度冷却,过度冷却会使其凝固而使气路堵塞,导致B中长导管内液面上升,
故答案为:冷却可避免溴的大量挥发;产品1,2-二溴乙烷的熔点(凝固点)低,过度冷却会凝固而堵塞导管.
点评 本题考查制备实验方案的设计,为高频考点,把握制备实验原理、混合物分离提纯实验等为解答的关键,侧重分析与实验能力的考查,题目难度中等.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
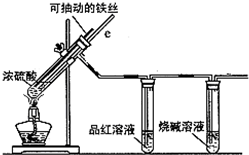 某校化学小组为探究铁与浓硫酸反应是否生成SO2,设计了以下装置进行实验.
某校化学小组为探究铁与浓硫酸反应是否生成SO2,设计了以下装置进行实验.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 物质 | 相对分子质量 | 熔点(℃) | 沸点 | 溶解度(g) | |
| 水 | 乙醇 | ||||
| 苯胺 | 93 | -6 | 184 | 3.42(20℃) | 任意比混溶 |
| 乙酸 | 60 | 17 | 117.9 | 任意比混溶 | 任意比混溶 |
| 乙酰苯胺 | 135 | 114 | 304 | 0.56(20℃) 3.45(50℃) 5.20(100℃) | 36.9(20℃) |

查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:推断题
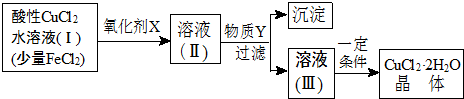
| Fe3+ | Fe2+ | Cu2+ | |
| 氢氧化物开始沉淀时的pH | 1.9 | 7 | 4.7 |
| 氢氧化物完全沉淀时的pH | 3.2 | 9 | 6.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在托盘天平的两托盘中分别放等质量的纸,称取2.0g NaOH固体 | |
| B. | 将NaOH固体在烧杯中溶解后迅速小心转移至250mL容量瓶中 | |
| C. | 定容时不小心加水超过了刻度线,此时迅速用胶头滴管吸出一些 | |
| D. | 摇匀后发现凹液面最底点低于刻度线,再补加蒸馏水到凹液面最底点与刻度线相平 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com