
分析 (1)根据n=$\frac{V}{{V}_{m}}$计算氨气物质的量,根据N=nNA计算氨气分子数目,氢原子物质的量为氨气分子的3倍;
(2)根据n=$\frac{m}{M}$计算二者物质的量之比,再结合分子式计算所含原子个数之比;
(3)根据n=$\frac{m}{M}$计算氨气的物质的量,根据H原子数目相等计算水的物质的量,再根据m=nM计算水的质量.
解答 解:(1)氨气物质的量为$\frac{11.2L}{22.4L/mol}$=0.5mol,氨气分子数目为0.5mol×6.02×1023mol-1=3.01×1023,氢原子物质的量为0.5mol×3=1.5mol,故答案为:3.01×1023;1.5;
(2)根据n=$\frac{m}{M}$可知等质量的SO2和SO3物质的量之比是80g/mol:64g/mol=5:4,所含的原子个数之比是5×3:4×4=15:16,故答案为:15:16;5:4;
(3)6.8g氨气的物质的量为$\frac{6.8g}{17g/mol}$=0.4mol,与之含有H原子数目相等水的物质的量为$\frac{0.4mol×3}{2}$=0.6ml,则水的质量为0.6mol×18g/mol=10.8g,
故答案为:10.8.
点评 本题考查物质的量有关计算,比较基础,注意对公式的理解与灵活应用.


 轻松课堂单元测试AB卷系列答案
轻松课堂单元测试AB卷系列答案 小题狂做系列答案
小题狂做系列答案科目:高中化学 来源: 题型:填空题
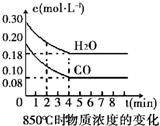 在一体积为10L的容器中,通入一定量的CO和H2O,在850℃时发生如下反应:CO(g)+H2O(g)?CO2(g)+H2 (g)△H<0.
在一体积为10L的容器中,通入一定量的CO和H2O,在850℃时发生如下反应:CO(g)+H2O(g)?CO2(g)+H2 (g)△H<0.| 时间(min) | CO | H2O | CO2 | H2 |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | c1 | c2 | c3 | c3 |
| 4 | c1 | c2 | c3 | c3 |
| 5 | 0.116 | 0.216 | 0.084 | |
| 6 | 0.096 | 0.266 | 0.104 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用稀硫酸可除去钢铁表面的铁锈 | |
| B. | 使用焰色反应可检验氯化钠中的钠离子 | |
| C. | 通过丁达尔效应可区分NaCl溶液和Al(OH)3胶体 | |
| D. | 向溶液中滴入硝酸银溶液产生白色沉淀,可证明含有Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若XY4分子中X原子处于正四面体的中心,则XY4分子为非极性分子 | |
| B. | C2H5OH与C2H5Br相比,前者的相对分子质量远小于后者,而沸点却远高于后者,其原因是前者的分子间存在氢键 | |
| C. | CO2与SiO2晶体熔化时,所克服的微粒间相互作用相同 | |
| D. | 短周期元素离子aXm+和bYn-具有相同的电子层结构,则a>b |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol•L-1 | B. | 1.5mol•L-1 | C. | 2mol•L-1 | D. | 2.5mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 2SO3.
2SO3.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com