
 在80℃时,将0.4mol的四氧化二氮气体充入2L已抽空的固定容积的密闭容器中,隔一段时间对该容器内的物质进行分析,得到如下数据:
在80℃时,将0.4mol的四氧化二氮气体充入2L已抽空的固定容积的密闭容器中,隔一段时间对该容器内的物质进行分析,得到如下数据:时间(s) C(mol/L) | 0 | 20 | 40 | 60 | 80 | 100 |
| C(N2O4) | 0.20 | a | 0.10 | c | d | e |
| C(NO2) | 0.00 | 0.12 | b | 0.22 | 0.22 | 0.22 |
分析 (1)根据根据表格知,0.12<b≤0.22,c≤0.10,据此判断b、c的关系,依据图表数据分析,反应物和生成物分析判断;
(2)化学平衡的三段式列式计算,结合化学反应速率概念计算0~20s内N2O4的平均反应速率;
(3)依据化学方程式和平衡常数概念写出平衡常数表达式,依据80°C平衡状态下结合三段式列式计算平衡浓度计算平衡常数;
(4)根据平衡常数的定义可知,K值越大,生成物浓度越大,反应物浓度越小,则反应正向进行的程度越大,据此答题;
(5)要增大该反应的K值,就是要使平衡正向移动,且平衡常数只与温度有关,根据影响平衡常数的外界因素可以作判断;
(6)根据温度对化学反应速率和化学平衡的影响,温度降低,化学反应速率减慢,到达平衡的时间长,同时,温度降低,化学平衡向放热的方向移动,即逆反应方向移动,N2O4浓度大于80°C的浓度,到达平衡所需时间长.
解答 解:(1)根据表格知,0.12<b≤0.22,c≤0.10,所以b>c;将0.4mol的四氧化二氮气体充入2L已抽空的固定容积的密闭容器中,反应的化学方程式为N2O4?2NO2,
故答案为:N2O4?2NO2,b>c;
(2)进行到20S;
N2O4?2NO2
起始量(mol) 0.4 0
变化量(mol) 0.12 0.24
20S末(mol) 0.28 0.24
20s时,N2O4的浓度=$\frac{0.28mol}{2L}$=0.14mol/L;
0~20s内N2O4的平均反应速率=$\frac{\frac{0.12mol}{2L}}{20s}$=0.003mol/(L•s);
故答案为:0.14;0.003mol/(L•s);
(3)N2O4?2NO2,平衡常数K=$\frac{{c}^{2}(N{O}_{2})}{c({N}_{2}{O}_{4})}$,
80°C平衡状态和60S是相同平衡状态,平衡浓度c(NO2)=0.22mol/L,c(N2O4)=0.09mol/L;
平衡常数K=$\frac{{c}^{2}(N{O}_{2})}{c({N}_{2}{O}_{4})}$═$\frac{0.2{2}^{2}}{0.09}$=0.54,
故答案为:$\frac{{c}^{2}(N{O}_{2})}{c({N}_{2}{O}_{4})}$;0.54;
(4)N2O4?2NO2,根据平衡常数的定义可知,K值越大,生成物浓度越大,反应物浓度越小,则反应正向进行的程度越大,
A.反应正向进行,K值越大,N2O4的转化率越高,故A正确
B.反应正向进行,K值越大,NO2的产量越大,故B正确;
C.K值越大,生成物浓度越大,反应物浓度越小,N2O4与NO2的浓度之比越小,故C错误;
D.K值越大,生成物浓度越大,反应物浓度越小,则反应正向进行的程度越大,故D正确;
故答案为:ABD.
(5)要增大该反应的K值,就是要使平衡正向移动,且平衡常数只与温度有关,根据影响平衡常数的外界因素可知,只有D正确;
故选D,
故答案为:D;
(6)应进行至100s后将反应混合物的温度降低,发现气体的颜色变浅.说明降温平衡逆向进行,逆反应为放热反应,正反应为吸热反应,
温度降低,化学反应速率减慢,到达平衡的时间长,同时,温度降低,化学平衡向放热的方向移动,即逆反应方向移动,60℃反应时N2O4浓度的变化的曲线
如右图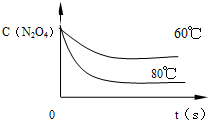 ,故答案为:
,故答案为: .
.
点评 本题考查了化学反应速率的计算、化学平衡常数的含义、化学图象分析和绘制等知识点,注意化学平衡常数只与温度有关,与物质的浓度无关,题目难度中等.


 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
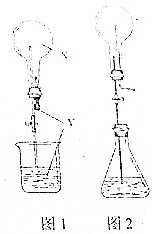 关于喷泉实验,回答下列问题:
关于喷泉实验,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 将0.2mol•L-1氨水与0.2mol•L-1盐酸混合,c(NH3•H20)+c(NH4+)=c(Cl-) | |
| B. | 常温下NH4A溶液中的pH=6,则c(A-)-c(NH4+)=9.9×10-7mol•L-1 | |
| C. | c(NH4+)相等的NH4Cl,NH4HCO3溶液中,溶质初始浓度:c(NH4Cl)=c(NH4HCO3) | |
| D. | 将0.2molCO2缓慢通入含有0.3molNAOH的溶液中,c(CO32-)>c(HCO3-)>c(H2CO3) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 红磷P(s)和Cl2(g)发生反应生成PCl3(g),继续反应生成PCl5(g).反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据).
红磷P(s)和Cl2(g)发生反应生成PCl3(g),继续反应生成PCl5(g).反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| B | ||
| A | C |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
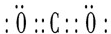 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳素钢的主要成分是铁碳合金、司母戊鼎的主要成分是铜锡合金 | |
| B. | 氨很容易液化,液氨气化吸收大量的热,所以液氨常用作致冷剂 | |
| C. | Al2O3用作耐火材料、Al(OH)3用作阻燃剂 | |
| D. | SO2可以用来漂白纸浆、毛、丝、草帽辫、增白食品等 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com