
| A. | 原子半径:As>Cl>P | B. | 热稳定性HCl>HBr>AsH3 | ||
| C. | 酸性:H3AsO4>H2SO4>H3PO4 | D. | 还原性:S2->Cl->Br- |
分析 A.电子层数越多,原子半径越大,同一周期元素,原子半径随着原子序数增大而减小;
B.非金属的非金属性越强,其氢化物越稳定;
C.非金属的非金属性越强,其最高价含氧酸的酸性越强;
D.非金属的非金属性越强,单质的氧化性越强,则其阴离子的还原性越弱.
解答 解:A.As在第四周期,P、Cl在第三周期,则原子半径大小顺序是As>P>Cl,故A错误;
B.非金属性:Cl>Br>As,则热稳定性:HCl>HBr>AsH3,故B正确;
C.非金属性:S>P>As,则酸性H2SO4>H3PO4>H3AsO4,故C错误;
D.单质的氧化性Cl2>Br2>S,单质的氧化性越强,则其阴离子的还原性越弱,所以阴离子的还原性:S2->Br->Cl-,故D错误;
故选B.
点评 本题考查物质的性质,注意把握同周期、同主族元素性质的递变规律,难度不大,侧重于基础知识的考查.


 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案科目:高中化学 来源: 题型:解答题


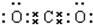


 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+、Na +、SO42-、SO32- | B. | NH4+、Mg 2+、SO42-、Cl - | ||
| C. | Na +、K +、HCO3-、Cl - | D. | K +、Na +、NO3-、CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 为探究Fe(NO3)2等硝酸盐热分解产物和产物的性质,某化学小组开展如下探究性学习:
为探究Fe(NO3)2等硝酸盐热分解产物和产物的性质,某化学小组开展如下探究性学习:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氟酸不能盛放在玻璃试剂瓶中 | |
| B. | 玻璃、水晶、陶瓷的主要成分均是硅酸盐 | |
| C. | 灼烧NaOH固体时不能使用瓷坩埚,因为坩埚中的SiO2能与NaOH反应 | |
| D. | 由沙子制备光伏材料时的反应之一为SiO2+2C $\frac{\underline{\;高温\;}}{\;}$Si+2CO↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某化学兴趣小组的同学为制取少量溴乙烷,查阅资料得知:
某化学兴趣小组的同学为制取少量溴乙烷,查阅资料得知:| 乙醇 | 溴乙烷 | |
| 状态 | 无色液体 | 无色液体 |
| 密度/g•cm-3 | 0.8 | 1.4 |
| 沸点/℃ | 78.5 | 119.0 |
| 熔点/℃ | -130 | 38.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 向某一容积为5L的密闭容器中,加入 0.2mol CO和0.2mol H2O,在800℃和催化剂存在的条件下,发生如下反应:CO(g)+H2O(g)?CO2(g)+H2(g)△H>0,反应中CO2的浓度随时间变化关系如图所示:
向某一容积为5L的密闭容器中,加入 0.2mol CO和0.2mol H2O,在800℃和催化剂存在的条件下,发生如下反应:CO(g)+H2O(g)?CO2(g)+H2(g)△H>0,反应中CO2的浓度随时间变化关系如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | a点溶液A、B的物质的量浓度相等 | |
| B. | 通常采用降温结晶的方法获得晶体B | |
| C. | 用蒸发浓缩、趁热过滤从C的溶液中分离出晶体C | |
| D. | 30℃时,A的饱和溶液的质量分数约为35% |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com