
| 选项 | 目的 | 分离方法 | 原理 |
| A | 分离溴水中的溴 | 乙醇萃取 | 溴在乙醇中的溶解度较大 |
| B | 分离乙酸乙酯和乙醇 | 分液 | 乙酸乙酯和乙醇的密度不同 |
| C | 除去乙烷中的乙烯 | 酸性高锰酸钾液体、洗气 | 乙烯可以用碱性高锰酸钾溶液除去氯化钠在水中的溶解度很大 |
| D | 除去丁醇中的乙醚 | 蒸馏 | 丁醇与乙醚的沸点相差较大 |
| A. | A | B. | B | C. | C | D. | D |
科目:高中化学 来源: 题型:选择题
| A. | Na2CO3 固体中混有少量NaHCO3:加热固体至质量恒定 | |
| B. | NaHCO3溶液中混有少量Na2CO3:往该溶液中通入过量CO2气体 | |
| C. | CO2中混有HCl:将其通过装NaOH溶液的洗气瓶 | |
| D. | FeCl2溶液中混有少量FeCl3:加入足量铁粉,搅拌,过滤 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 实验编号 | 待测液体积 (mL) | 消耗盐酸体积(mL) | |
| 初读数 | 末读数 | ||
| 1 | 20.00 | 0.00 | 25.02 |
| 2 | 20.00 | 0.20 | 28.80 |
| 3 | 20.00 | 1.30 | 26.28 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属钠着火时可用水扑灭 | |
| B. | 酒精灯着火时用湿抹布扑盖 | |
| C. | 蒸发结晶时,为得到更多晶体直接将溶液蒸干 | |
| D. | 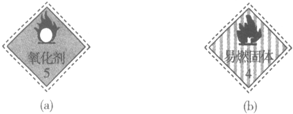 实验室可分别将贴有标志(a)和标志(b)的药品放在同一橱柜中 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化氢气体不能导电,所以氯化氢不是电解质 | |
| B. | SO2溶于水形成的溶液能导电,所以SO2是电解质 | |
| C. | 碳棒能导电但属于非电解质 | |
| D. | 电解质不一定能导电 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(Al3+)=0.1mol/L的溶液中:Na+、K+、HS-、SO42- | |
| B. | 使酚酞呈红色的溶液中:K+、Ba2+、I-、NO3- | |
| C. | 由水电离出的c(H+)=10-13mol/L的溶液中:Na+、HCO3-、Cl-、Br- | |
| D. | 加入Al能放出H2的溶液中:Cl-、SO42-、NO3-、Mg2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将SO2通入Ba(NO3)2溶液中能生成BaSO4沉淀 | |
| B. | 在Si02+3C$\frac{\underline{\;高温\;}}{\;}$SiC+2C0的反应中,Si02是氧化剂 | |
| C. | 生铁在潮湿的空气中主要发生析氢腐蚀 | |
| D. | 某钾盐溶于盐酸,产生能使澄清石灰水变浑浊的无色气体,说明该钾盐是K2CO3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com