
下表为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,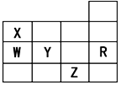 正确的是
正确的是
常压下五种元素的单质中Z单质的沸点最高 B、Y、Z的阴离子电子层结构都与R原子的相同
C、W的氢化物的沸点比X的氢化物的沸点高 D、Y元素的非金属性比W元素的非金属性强
 智慧小复习系列答案
智慧小复习系列答案科目:高中化学 来源: 题型:
现有A、 B、C、D、E、F、G七种短周期主族元素,原子序数依次增大。已知A与D,C与F分别同主族,D、E、F、G同周期,A分别与B、C可形成含有10个电子的共价化合物分子,B的最外层电子数是其次外层电子数的2倍,且A、B的最外层电子数之和比C的最外层电子数少1;E位于B的前一主族。
B、C、D、E、F、G七种短周期主族元素,原子序数依次增大。已知A与D,C与F分别同主族,D、E、F、G同周期,A分别与B、C可形成含有10个电子的共价化合物分子,B的最外层电子数是其次外层电子数的2倍,且A、B的最外层电子数之和比C的最外层电子数少1;E位于B的前一主族。
请回答下列问题。
(1)元素G在周期表中的位置为____________________,F的原子结构示意图为____________________。
(2)A、C、D三种元素组成一种常见化合物,该化合物所含的化学键类型为____________________,工业上利用某一反应可同时生产该化合物和G的单质,写出该反应的离子方程式________________________________________________________
________________________________________________________________________。
(3)D、E元素的最高价氧化物对应的水化物之间反应的离子方程式为________________________________________________________________________。
(4)含有E的简单阳离子的盐常用作净水剂,其原因为___________________________
_____________________________________________________________________________________________________________________(用离子方程式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列物质的沸点逐渐升高的是
A、NH3 PH3 AsH3 SbH3 B、 Si SiC H2O CO2
C、NaI NaBr NaCl NaF D、 Li Na K Rb
查看答案和解析>>
科目:高中化学 来源: 题型:
下列对一些实验事实的理论解释正确的是
| 选项 | 实验事实 | 理论解释 |
| A | 氮原子的第一电离能大于氧原子 | 氮原子2p能级半充满 |
| B | CO2为直线形分子 | CO2分子中C—O是极性键 |
| C | 金刚石的熔点低于石墨 | 金刚石是分子晶体,石墨是原子晶体 |
| D | HF的沸点高于HCl | HF的相对分子质量小于HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:
元素周期表中前7周期的元素种数如下:
| 周期 | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| 元素种数 | 2 | 8 | 8 | 18 | 18 | 32 | 32 |
请分析周期表与元素种数的关系,然后预言第8周期最多可能含有的元素种数( )
A.18 B.32 C.50 D.64
查看答案和解析>>
科目:高中化学 来源: 题型:
氢氧燃料电池是一种高效、环境友好的发电装置,它是以铂作电极,KOH溶液作电解液,总反应为:2H2 + O2 = 2H2O,正极反应为:O2 + 2H2O + 4e- = 4OH- 下列叙述不正确的是( )
A.H2通入负极区 B.O2通入正极区
C.负极发生氧化反应 D.正极发生氧化反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com