
【题目】X、Y、Z、W是原子序数依次增大的短周期元素,且互不同族;其中只有两种为金属;X原子的最外层子数与次外层电子数相等;X与W、Y与Z这两对原子的最外层电子数之和均为9.单质Y和W都可与浓的NaOH溶液反应.请回答下列问题:
(1)Y、Z、W的原子半径由小到大的顺序 .
(2)ZW2的电子式是 .
(3)实验室制备Y的最高价氧化物的水化物的离子方程式是
(4)X与Y化学性质相似,则X与浓的NaOH溶液反应的化学方程式是
(5)0.1mol的单质W与50mL 1.5mol/L的FeBr2溶液反应,则被氧化的Fe2+和Br﹣的物质的量之比是 .
【答案】(1)Cl<S<Al;
(2)![]() ;
;
(3)Al3++3NH3.H2O=Al(OH)3↓+3NH4+;
(4)Be+2NaOH=Na2BeO2+H2↑;
(5)3:5.
【解析】试题分析:X、Y、Z、W是原子序数依次增大的短周期元素,且互不同族,“X原子的最外层电子数与次外层电子数相等”,短周期中只有Be和Ar,此处显然X是Be;四元素有两种为金属,则Y、Z、W一定处于第三周期,X与W原子的最外层电子数之和为9,则W处于ⅦA族,为Cl元素;Y与Z原子的最外层电子数之和为9,则Y处于ⅢA族、Z处于ⅥA族,故Y为Al元素、Z为S元素,据此解答.
解:X、Y、Z、W是原子序数依次增大的短周期元素,且互不同族,“X原子的最外层电子数与次外层电子数相等”,短周期中只有Be和Ar,此处显然X是Be;四元素有两种为金属,则Y、Z、W一定处于第三周期,X与W原子的最外层电子数之和为9,则W处于ⅦA族,为Cl元素;Y与Z原子的最外层电子数之和为9,则Y处于ⅢA族、Z处于ⅥA族,故Y为Al元素、Z为S元素,
(1)同周期自左而右原子半径减小,故原子半径Cl<S<Al,
故答案为:Cl<S<Al;
(2)SCl2中S原子与Cl原子之间形成1对共用电子对,其电子式是![]() ,
,
故答案为:![]() ;
;
(3)实验室制备氢氧化铝的离子方程式是:Al3++3NH3.H2O=Al(OH)3↓+3NH4+,故答案为:Al3++3NH3.H2O=Al(OH)3↓+3NH4+;
(4)Be与Al化学性质相似,则Be与浓的NaOH溶液反应的化学方程式是:Be+2NaOH=Na2BeO2+H2↑,故答案为:Be+2NaOH=Na2BeO2+H2↑;
(5)氯气能将亚铁离子和溴离子氧化,先氧化亚铁离子后氧化溴离子,50mL 1.5mol/L的FeBr2溶液中Fe2+的物质的量=0.05L×1.5mol/L=0.075mol,Br﹣的物质的量=0.05L×1.5mol/L×2=0.15mol,根据电子转移守恒,0.075molFe2+完全被氧化需要氯气的物质的量=![]() =0.0375mol<0.1mol,故0.075molFe2+完全被氧化,剩余氯气为0.1mol﹣0.0375mol=0.0625mol,根据电子转移守恒可以氧化溴离子
=0.0375mol<0.1mol,故0.075molFe2+完全被氧化,剩余氯气为0.1mol﹣0.0375mol=0.0625mol,根据电子转移守恒可以氧化溴离子![]() =0.125mol<0.15mol,故被氧化的Fe2+和Br﹣的物质的量之比=0.075mol:0.125mol=3:5,
=0.125mol<0.15mol,故被氧化的Fe2+和Br﹣的物质的量之比=0.075mol:0.125mol=3:5,
故答案为:3:5.


科目:高中化学 来源: 题型:
【题目】硫酸是一种重要的化工产品,目前主要采用“接触法”进行生产.下列对于反应 2SO2+O2 ![]() 2SO3的说法中正确的是( )
2SO3的说法中正确的是( )
A. 只要选择适宜的条件,SO2和O2就能全部转化为SO3
B. 在工业合成SO3时,要同时考虑反应速率和反应能达到的限度两方面的问题
C. 该反应达到平衡后,反应就完全停止了,即正逆反应速率均为零
D. 在达到平衡的体系中,充入由18O原子组成的O2后,18O仅存在于SO2和SO3中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA表示阿伏加德罗常数,下列说法正确的是( )
A.2.24LCO或N2所含的电子数为1.4NA
B.标准状况下,22.4升H2O中所含分子数小于NA
C.常温常压下,33.6L氯气与56 g铁充分反应,转移的电子数为3NA
D.常温常压下,1.8 g H2O含有的质子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,小试管内盛有约3 mL饱和硫酸铜溶液,与锥形瓶连通的U型细管内盛有少量水(为便于观察,预先染成红色),沿小试管的内壁小心地慢慢注入约3 mL浓硫酸,静置片刻,不可能观察到的现象是( )

A. 小试管内液体分成两层,上层蓝色,下层无色
B. U型细管内左边液面下降,右边液面升高
C. 小试管内有少量白色固体析出
D. 小试管内液体不分层,但有蓝色晶体析出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于组成生物体化学元素的论述,正确的是
A. 组成生物体的化学元素中,碳元素含量最多
B. 动物和植物所含的化学元素的种类差异很大
C. 无机自然界中的元素都可以参与组成生物体
D. 微量元素是维持正常生命活动不可缺少的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(2014·课标全国卷Ⅰ,11,6分)溴酸银(AgBrO3)溶解度随温度变化曲线如图所示,下列说法错误的是( )

A.溴酸银的溶解是放热过程
B.温度升高时溴酸银溶解速度加快
C.60 ℃时溴酸银的Ksp约等于6×10-4
D.若硝酸钾中含有少量溴酸银,可用重结晶方法提纯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由NO和CO组成的混合气体与同温同压下空气的密度相等(空气的平均相对分子质量为29),下列关系正确的是( )
A. 混合气体中,CO与NO质量比15:14
B. 混合气体中,CO与NO分子个数比1:2
C. 混合气体中CO占有的体积大于NO占有的体积
D. 混合气体中,CO与NO密度比14:15
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.某二元酸(化学式用H2A表示)在水中的电离方程式是:H2A = H+ + HA-,HA-![]() H++A2-。回答下列问题:
H++A2-。回答下列问题:
(1)在0.1mol·L-1的Na2A溶液中,下列微粒浓度关系不正确的是_________。
A.c(A2-)+c(HA-)+c(H2A)=0.1mol·L-1
B.c(OH-)=c(H+)+c(HA-)
C.c(Na+)+c(H+)=c(OH-)+c(HA-)+2c(A2-)
D.c(Na+)=2c(A2-)+2c(HA-)
(2)已知0.1mol·L-1NaHA溶液的pH=2,则0.1mol·L-1H2A溶液中氢离子的物质的量浓度________(填“>”、“<”或“=”)0.11mol·L-1。
II.亚磷酸(H3PO3)是二元酸,H3PO3溶液存在电离平衡:H3PO3![]() H+ +H2PO3-。亚磷酸与足量NaOH溶液反应,生成Na2HPO3。
H+ +H2PO3-。亚磷酸与足量NaOH溶液反应,生成Na2HPO3。
(1)①某温度下,0.1000 mol·L-1的H3PO3溶液中c (H+) = 2.5×10-2mol·L-1,除OH-之外其他离子的浓度由大到小的顺序是 ,
②写出亚磷酸与少量NaOH溶液反应的离子方程式 。
III.“低碳经济”时代,科学家利用“组合转化”等技术对CO2进行综合利用。
(1)CO2和H2在一定条件下可以生成乙烯:6H2(g)+2CO2(g)![]() CH2==CH2(g)+4H2O(g) △H=a kJ·mol-1 已知:H2(g)的燃烧热为285.8 kJ·mol-1,CH2=CH2(g)的燃烧热为1411.0 kJ·mol-1,H2O(g)= H2O(l) △H=-44.0 kJ·mol-1,则a=______kJ·mol-1。
CH2==CH2(g)+4H2O(g) △H=a kJ·mol-1 已知:H2(g)的燃烧热为285.8 kJ·mol-1,CH2=CH2(g)的燃烧热为1411.0 kJ·mol-1,H2O(g)= H2O(l) △H=-44.0 kJ·mol-1,则a=______kJ·mol-1。
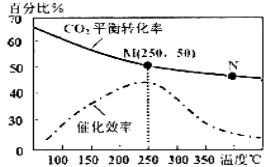
(2)上述生成乙烯的反应中,温度对CO2的平衡转化率及催化剂的催化效率影响如右上图,下列有关说法不正确的是_______(填序号)
①温度越高,催化剂的催化效率越高
②M点平衡常数比N点平衡常数大
③温度低于250℃时,随着温度升高,乙烯的产率增大
④增大压强可提高乙烯的体积分数
⑤N点正反应速率一定大于M点正反应速率
IV.为减轻大气污染,可在汽车尾气排放处加装催化转化装置,反应方程式为:
2NO(g)+2CO(g)![]() 2CO2(g)+N2(g)。
2CO2(g)+N2(g)。
(3)若在500℃时,投料![]() =1 且NO的起始浓度为amol/L,NO的转化率为80%,则此温度时的平衡常数K=________。
=1 且NO的起始浓度为amol/L,NO的转化率为80%,则此温度时的平衡常数K=________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,0.1molL-1某一元酸(HA)溶液![]() 中= 1×10-8,相同物质的量浓度的某一元碱(BOH)溶液中
中= 1×10-8,相同物质的量浓度的某一元碱(BOH)溶液中![]() = 1×1012,下列叙述正确的是( )
= 1×1012,下列叙述正确的是( )
A.PH=a的HA溶液,稀释10倍,其pH=a+1
B.等体积的HA和BOH恰好完全反应,溶液的pH=7
C.HA的pH=3;BOH的pH=13
D.相同体积相同pH的HA和盐酸分别与足量Zn反应,生成氢气的物质的量相同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com