
| A. | 铊(Tl)与铝同主族,其单质既能与盐酸反应,又能与氢氧化钠溶液反应 | |
| B. | 氟的非金属性比氯强,其最高价氧化物对应水化物的酸性比HClO4强 | |
| C. | 硒(Se)位于第四周期 VIA,其气态氢化物不如HCl稳定 | |
| D. | 第二周期非金属元素的气态氢化物溶于水后,水溶液均为酸性 |
分析 A.根据元素周期表中同主族元素性质的变化规律来分析;
B.元素的非金属性越强,其最高价氧化物对应的水化物的酸性越强,但是F无含氧酸;
C.元素的非金属性越强,对应的氢化物越稳定;
D.氨气溶于水,其溶液显碱性.
解答 解:A.铊(Tl)与铝同主族,随原子序数的增大,金属性增强,则金属性Tl>Al,则Tl能与酸反应,但不与氢氧化钠溶液反应,故A错误;
B.非金属性F>Cl,F无含氧酸,故B错误;
C.S、Se在同一主族,S元素的非金属性大于Se的非金属性,则硒的氢化物不如硫化氢稳定,又由于HCl的稳定性强于硫化氢,故硒化氢不如HCl稳定,故C正确;
D.第二周期非金属元素N,其氢化物为氨气,氨气溶于水,水溶液为碱性,故D错误.
故选:C.
点评 本题考查元素周期表中同周期和同主族元素的性质变化规律,学生明确金属性与非金属性强弱的比较方法是解答本题的关键,难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 阴离子数和阳离子数 | |
| B. | 阳离子的正电荷总数和阴离子的负电荷总数 | |
| C. | 阴、阳离子的质量 | |
| D. | 每个阳离子与每个阴离子所带的电荷 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 生铁中含有碳,抗腐蚀能力比纯铁弱 | |
| B. | 用锡焊接的铁质器件,焊接处易生锈 | |
| C. | 水库的钢闸门连电源正极不易被腐蚀 | |
| D. | 轮船船体镶嵌锌块,船体不易被腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
. .
.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸、碱、盐都是电解质 | |
| B. | 蔗糖、酒精是非电解质 | |
| C. | 盐酸是强电解质 | |
| D. | NH3的水溶液能导电,但NH3不是电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
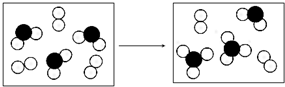
 表示碳原子,用
表示碳原子,用  表示氧原子,用
表示氧原子,用  表示氮原子,如图为气体转换的微观过程.请你根据图示回答下列问题:
表示氮原子,如图为气体转换的微观过程.请你根据图示回答下列问题: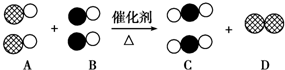
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com