

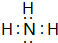 ,D是CO2,结构式为O=C=O,
,D是CO2,结构式为O=C=O,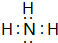 ;O=C=O;
;O=C=O;
| ||
| △ |
| ||
| △ |


科目:高中化学 来源: 题型:
| A、75% | B、25% |
| C、50% | D、无法计算 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 化学键 | Si-Si键 | H-H键 | Cl-Cl键 | H-Cl键 | Si-Cl键 |
| 键能(KJ/mol) | 176 | 436 | 243 | 431 | 360 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 有 X、Y、Z、W四种元素,其中X是周期表中原子半径最小的元素,Y原子基态时最外层电子数是其内层电子数的2倍,Z原子基态时2p原子轨道上有3个未成对的电子,W的原子序数为29.回答下列问题:
有 X、Y、Z、W四种元素,其中X是周期表中原子半径最小的元素,Y原子基态时最外层电子数是其内层电子数的2倍,Z原子基态时2p原子轨道上有3个未成对的电子,W的原子序数为29.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
| 3 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:

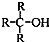 )不能氧化成醛或酮.
)不能氧化成醛或酮.查看答案和解析>>
科目:高中化学 来源: 题型:
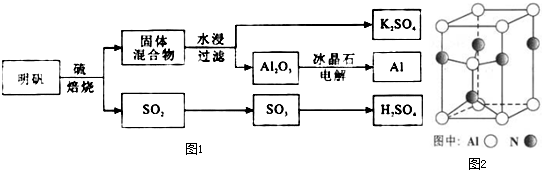
查看答案和解析>>
科目:高中化学 来源: 题型:
| t/s | 0 | 500 | 1000 | 1500 |
| c(N2O5)/(mol?L-1) | 5.00 | 3.52 | 2.50 | 2.50 |
| A、500 s内N2O5分解速率为2.96×10-3mol?L-1?s-1 | ||
| B、T1温度下的平衡常数K1=125(mol?L-1)3,平衡时N2O5的转化率为50% | ||
| C、T1温度下的平衡常数为K1,T2温度下的平衡常数为K2,若T1>T2,则K1<K2 | ||
D、达平衡后其他条件不变,将容器的体积压缩到原来的
|
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com