
| A、探究浓度对反应速率的影响 |
| B、探究温度对反应速率的影响 |
| C、探究固体表面积对反应速率的影响 |
| D、探究催化剂对反应速率的影响 |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、一定没有CO2,肯定有H2 |
| B、一定有CO、CO2和水蒸气? |
| C、一定有H2、CO2和HCl |
| D、可能有CO2、NH3和水蒸气? |
查看答案和解析>>
科目:高中化学 来源: 题型:
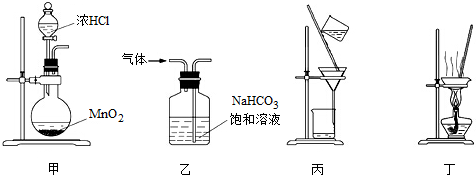
| A、用装置甲制取氯气 |
| B、用装置乙除去氯气中混有的少量氯化氢 |
| C、用装置丙分离二氧化锰和氯化锰溶液 |
| D、用装置丁蒸干氯化锰溶液制MnCl2?4H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、只滴加氨水鉴别NaCl、AlCl3、MgCl2、Na2SO4四种溶液 |
| B、将NH4Cl溶液蒸干制备NH4Cl固体 |
| C、用萃取分液的方法除去酒精中的水 |
| D、用可见光束照射以区别溶液和胶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
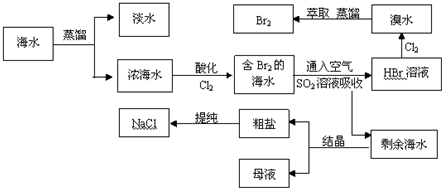
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素A | 元素B | 元素C | 元素X | 元素Y | 元素Z |
| 单质是一种常见金属,与元 素X形成黑色和红棕色三种常见化合物 |
单质是一种黄绿色气体 | 短周期中金属性最强,与X 反应能生成两种常见化合物 |
最外层电子数是内层电子数的3倍,能形 成双原子阴离子 |
单质为双原子分子,结构中б键与π键数 目比为1:2 |
阳离子就是一个质子 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| 实验序号 | A溶液 | B溶液 |
| ① | 20mL 0.1mol?L-1H2C2O4溶液 | 30mL 0.01mol?L-1KMnO4溶液 |
| ② | 20mL 0.2mol?L-1H2C2O4溶液 | 30mL 0.01mol?L-1KMnO4溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 3 |
| 4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com