
| A、容器内气体密度不再发生变化 |
| B、容器内各物质的浓度不再发生变化 |
| C、正反应和逆反应都已停止 |
| D、单位时间消耗0.1mol N2的同时生成0.2mol NH3 |


 灵星计算小达人系列答案
灵星计算小达人系列答案 孟建平错题本系列答案
孟建平错题本系列答案科目:高中化学 来源: 题型:
| t/s | 0 | 500 | 1000 |
| c(N2O5) mol/L | 5.00 | 3.25 | 2.48 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1种 | B、2种 | C、3种 | D、4种 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向Na2CO3饱和溶液中通入CO2,有NaHCO3结晶析出 |
| B、工业上制取单质硅 |
| C、Na2O2作呼吸面具中的供氧剂 |
| D、一定条件下用硫酸铜制Cu |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CH3-C-18OHO和CH3CH2OH |
| B、CH3-C-18OHO和CH3CH2-18OH |
| C、CH3-C-18OH18O和CH3CH2-18OH |
| D、CH3-C-OHO和CH3CH2OH |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| △ |
| A的转化率% | P1(MPa) | P2(MPa) |
| 200℃ | 89.7 | 76.3 |
| 600℃ | 83.8 | 71.6 |
A、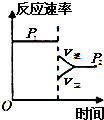 |
B、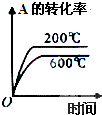 |
C、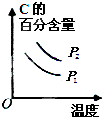 |
D、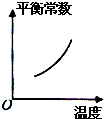 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、被还原的HNO3不可能是
| ||
B、溶液中剩余的n(NO3-)≤(0.4-
| ||
| C、溶液中不可能同时存在Fe2+、Fe3+、Cu2+ | ||
| D、被还原的硝酸为0.8a mol时,则溶液中一定含有Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素性质 | 元素编号 | |||||
| ① | ② | ③ | ④ | ⑤ | ⑥ | |
| 氢化物的沸点(℃) | -60.7 | -33.4 | 100 | -87.7 | 19.54 | -84.9 |
| 最高化合价 | +6 | +5 | +5 | +7 | ||
| 最低化合价 | -2 | -3 | -2 | -3 | -1 | -1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com