

分析 Ⅰ.(1)Ⅱ和Ⅰ相比反应速率加快,不影响平衡移动,正反应为气体物质的量减小的反应,应是使用催化剂;
(2)恒温恒容下,压强之比等于气体物质的量之比,故平衡时混合气体总物质的量为(2+4)mol×$\frac{1.0aKpa}{2.0akPa}$=3mol,则:
CO(g)+2H2 (g)?CH3OH(g)物质的量减小△n=2
起始量(mol):2 4 0
变化量(mol):1.5 3 1.5 6-3=3
平衡量(mol):0.5 1 1.5
再根据v=$\frac{△c}{△t}$计算v(CH3OH);
(3)Ⅱ、Ⅰ温度相同,平衡常数相同,根据K=$\frac{c(CH{\;}_{3}OH)}{c(CO)•c{\;}^{2}(H{\;}_{2})}$计算平衡常数;
(4)反应Ⅲ达平衡时所用的时间比反应Ⅰ达平衡时所用的时间长,化学反应速率快,且Ⅲ平衡时压强比I小,与I相比平衡正向移动,正反应为气体体积减小放热反应,应降低温度;
Ⅱ、(5)根据图知,交换膜是质子交换膜,则电解质溶液呈酸性,根据氢离子移动方向知,通入a的电极为负极、通入b的电极为正极,负极上甲醇失去电子发生氧化反应;
(6)电解氯化钠溶液的化学方程式为2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+H2↑+Cl2↑,可知关系式1 mol CH4~8 mol e-~8molNaOH计算.
解答 解:Ⅰ.(1)Ⅱ和Ⅰ相比反应速率加快,不影响平衡移动,正反应为气体物质的量减小的反应,应是使用催化剂,
故答案为:Ⅱ中使用催化剂;
(2)恒温恒容下,压强之比等于气体物质的量之比,故平衡时混合气体总物质的量为(2+4)mol×$\frac{1.0aKpa}{2.0akPa}$=3mol,则:
CO(g)+2H2 (g)?CH3OH(g)物质的量减小△n=2
起始量(mol):2 4 0
变化量(mol):1.5 3 1.5 6-3=3
平衡量(mol):0.5 1 1.5
则v(CH3OH)=$\frac{\frac{1.5mol}{2L}}{6min}$=0.125 mol/(L.min),
故答案为:0.125 mol/(L.min);
(3)Ⅱ、Ⅰ温度相同,平衡常数相同,平衡常数K(Ⅱ)=K=$\frac{c(CH{\;}_{3}OH)}{c(CO)•c{\;}^{2}(H{\;}_{2})}$=$\frac{\frac{1.5}{2}}{\frac{0.5}{2}×(\frac{1}{2})^{2}}$=12,
故答案为:12;
(4)反应Ⅲ达平衡时所用的时间比反应Ⅰ达平衡时所用的时间长,化学反应速率快,且Ⅲ平衡时压强比I小,与I相比平衡正向移动,正反应为气体体积减小放热反应,应降低温度,故温度T1温度更高,
故答案为:>;此反应为放热反应,降低温度,反应速率减慢,平衡向正反应方向移动;
Ⅱ、(5)根据图知,交换膜是质子交换膜,则电解质溶液呈酸性,根据氢离子移动方向知,通入a的电极为负极、通入b的电极为正极,负极上甲醇失去电子发生氧化反应,负极反应式为 CH3OH-6e-+H2O=CO2+6H+,正极上氧气得电子发生还原反应,电极反应式为O2+4e-+4H+=2H2O,
故答案为:负;CH3OH-6e-+H2O=CO2+6H+;
(6)电解氯化钠溶液的化学方程式为2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+H2↑+Cl2↑,可知关系式1 mol CH4~8 mol e-~8molNaOH,故若每个电池甲烷通入量为0.224L(标准状况),生成0.08molNaOH,c(NaOH)=$\frac{0.08mol}{0.8L}$=0.1mol/L,pH=13;电解池通过的电量为$\frac{0.224L}{22.4L/mol}$×8×9.65×104C•mol-1=7.72×103C(题中虽然有两个燃料电池,但电子的传递量只能用一个池的甲烷量计算),
故答案为:7.72×103C;13.
点评 本题考查化学平衡计算与影响因素、化学平衡图象、反应速率与平衡常数及电极判断与电极反应式书写等问题,题目难度中等,明确化学平衡及其影响为解答关键,注意掌握三段式在化学计算中的应用,试题培养了学生的化学计算能力.


 一线名师提优试卷系列答案
一线名师提优试卷系列答案科目:高中化学 来源:2016-2017学年甘肃省高二上10月月考化学试卷(解析版) 题型:选择题
把80mL氢氧化钠 溶液加入到120mL盐酸中,所得溶液的pH为2。如果混合前氢氧化钠溶液和盐酸的物质的量浓度相同,它们的浓度是 ( )
溶液加入到120mL盐酸中,所得溶液的pH为2。如果混合前氢氧化钠溶液和盐酸的物质的量浓度相同,它们的浓度是 ( )
A.0.5mol/L B.0.1mol/L C.0.05mol/L D.1mol/L
查看答案和解析>>
科目:高中化学 来源:2017届重庆一中高三上学期第二次月考化学试卷(解析版) 题型:选择题
下列物质的制备与工业生产相符的是
①NH3  NO
NO 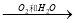 HNO3
HNO3
②浓HCl 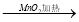 Cl2
Cl2  漂白粉
漂白粉
③MgCl2(aq) 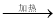 无水MgCl2
无水MgCl2  Mg
Mg
④饱和NaCl(aq) 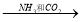 NaHCO3
NaHCO3 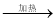 Na2CO3
Na2CO3
⑤铝土矿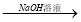 NaAlO2溶液
NaAlO2溶液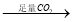 Al(OH)3
Al(OH)3 Al2O3
Al2O3  Al
Al
A.①④⑤ B.①③⑤ C.②③④ D.②④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 化学键 | H-H | C-O | C≡O | H-O | C-H |
| E/(kJ•mol-1) | 436 | 343 | x | 465 | 413 |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 纤维素、蛋白质、油脂都是高分子化合物 | |
| B. | 糖类、蛋白质、油脂都是由C、H、O三种元素组成的 | |
| C. | 油脂有油和脂肪之分,但都属于酯 | |
| D. | 只用淀粉溶液就可鉴别市售食盐是否为加碘盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 150 mL 1 mol•L-1Na3PO4溶液 | B. | 75 mL 2 mol•L-1NaNO3溶液 | ||
| C. | 75 mL 3 mol•L-1Na2SO4溶液 | D. | 150 mL 2mol•L-1NaCl溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化碳与赤热的炭反应生成一氧化碳 | |
| B. | 葡萄糖在人体内氧化 | |
| C. | 生石灰制熟石灰 | |
| D. | Ba(OH)2•8H2O与NH4Cl反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com