I.下列是四组同学用铜制取硫酸铜晶体的方案:
甲组:将铜粉投入盛有稀硫酸的容器中,无反应.向容器底部缓缓鼓入氧气,溶液慢慢变蓝色,若在溶液中放置些铂丝,反应速率明显加快.
乙组:Cu
CuO
CuSO
4 丙组:Cu
Cu(NO
3)
2Cu(OH)
2CuSO
4丁组:Cu
CuSO
4(1)甲组实验用一个化学反应方程式表示:
2Cu+O2+2H2SO4=2CuSO4+2H2O
2Cu+O2+2H2SO4=2CuSO4+2H2O
;使反应变快的可能原因是
;从该反应器溶液(含有少量H
2SO
4以抑制水解)中取得产品的实验操作步骤应为
加热蒸发
加热蒸发
、
结晶冷却
结晶冷却
、过滤并洗涤晶体,取得产品后的残留物质可循环使用.
(2)可持续发展的原则要求化工生产①原理科学;②能量消耗低;③原料利用率高;④无污染.则在四组方案中,
甲
甲
组方案最好.
II.另一化学兴趣小组从化学手册上查得硫酸铜500℃以上按照下式分解:CuSO
4CuO+SO
2↑+SO
3↑+O
2↑为此他们设计了如图所示实验装置测定有关数据,并经计算确定该条件下CuSO
4分解反应方程式中各物质的化学计量数.

实验测得数据及有关结果如下;
①准确称取4.80g无水CuSO
4;②实验结束时干燥管D总质量增加1.92g;③测得量筒F中水的体积,得出气体在标准状况下的体积为224.0mL.试回答下列问题:
(3)装置B的作用是
吸收SO3,放出等物质的量的SO2
吸收SO3,放出等物质的量的SO2
.
(4)装置C的作用是
吸收水分干燥SO2和O2
吸收水分干燥SO2和O2
.
(5)为减少测量气体体积引起的误差,应注意的事项有:
此处不填
此处不填
①装置内气体的温度应恢复到室温,②调节量筒使其液面与E装置中的液面持平,③
读量筒中液体体积时,视线与液体的凹液面相平;
读量筒中液体体积时,视线与液体的凹液面相平;
(6)通过计算,推断出该条件下反应的化学方程式
3CuSO
43CuO+2SO
2↑+SO
3↑+O
2↑
3CuSO
43CuO+2SO
2↑+SO
3↑+O
2↑
.

 新卷王期末冲刺100分系列答案
新卷王期末冲刺100分系列答案 全能闯关100分系列答案
全能闯关100分系列答案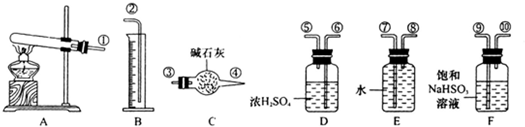

 (2012?上海模拟)由中国科研人员从中药材中提取的金丝桃素对人工感染的H5N1亚型禽流感家禽活体具有100%的治愈率.根据下面金丝桃素的结构简式回答下列问题:
(2012?上海模拟)由中国科研人员从中药材中提取的金丝桃素对人工感染的H5N1亚型禽流感家禽活体具有100%的治愈率.根据下面金丝桃素的结构简式回答下列问题:

 +2H2O
+2H2O +2H2O
+2H2O

 某化学兴趣小组,通过右图装置进行硫酸与铜反应的实验探究.
某化学兴趣小组,通过右图装置进行硫酸与铜反应的实验探究.