
【题目】(1)某学校实验室从化学试剂商店买回18.4 mol·L-1的硫酸。现用该浓硫酸配制100 mL 1 mol·L-1的稀硫酸。配制100 mL 1 mol·L-1的稀硫酸需要用量筒量取上述浓硫酸的体积为____mL(保留一位小数),量取浓硫酸时应选用________(填字母)规格的量筒。
A.10 mL B.50 mL C.100 mL
(2)取50 mL Na2CO3、Na2SO4的混合溶液,加入过量的BaCl2溶液后得29.02g白色沉淀,用过量的稀硝酸处理后沉淀量减少到9.32g,并有气体放出。试计算:
①原混合物中Na2SO4物质的量浓度为____________;
②产生的气体在标准状况下的体积为________________。
【答案】 5.4 a 0.8mol/L 2.24L
【解析】试题分析:(1)根据稀释前后溶质物质的量不变计算配制100 mL 1 mol·L-1的稀硫酸需要浓硫酸的体积;(2)Na2CO3、Na2SO4的混合溶液,加入过量的BaCl2溶液后得硫酸钡、碳酸钡沉淀共29.02g,用过量的稀硝酸处理,碳酸钡溶解,剩余9.32g沉淀是硫酸钡。
解析:(1)设配制100 mL 1 mol·L-1的稀硫酸需要浓硫酸的体积是VL,根据稀释前后溶质物质的量不变,![]() ,V=0.0054L=5.4mL;应选用10mL规格的量筒量取,故选A。
,V=0.0054L=5.4mL;应选用10mL规格的量筒量取,故选A。
(2)根据以上分析,硫酸钡、碳酸钡沉淀共29.02g,用过量的稀硝酸处理,碳酸钡溶解,剩余9.32g沉淀是硫酸钡,硫酸钡的物质的量是![]() ,碳酸钡的质量是29.02g-9.32g=19.7g,碳酸钡的物质的量是
,碳酸钡的质量是29.02g-9.32g=19.7g,碳酸钡的物质的量是![]() ;①根据硫元素守恒,原混合物中Na2SO4物质的量是0.04mol,Na2SO4物质的量浓度是
;①根据硫元素守恒,原混合物中Na2SO4物质的量是0.04mol,Na2SO4物质的量浓度是![]() 0.8mol/L;②根据碳元素守恒,生成二氧化碳的物质的量是0.1mol,在标准状况下的体积为
0.8mol/L;②根据碳元素守恒,生成二氧化碳的物质的量是0.1mol,在标准状况下的体积为![]() 。
。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】下列有关物质的性质与用途不具有对应关系的是
A.浓硫酸具有脱水性,可用作干燥剂
B.氧化铝熔点高,可用作耐高温材料
C.氢氧化铁胶体具有吸附性,可用于净水
D.小苏打能与盐酸反应,可用于治疗胃酸过多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国的“神州七号”载人飞船已发射成功,“嫦娥”探月工程已正式启动.据科学家预测,月球的土壤中吸附着数百万吨的 ![]() He,每百吨
He,每百吨 ![]() He核聚变所释放出的能量相当于目前人类一年消耗的能量.在地球上,氦元素主要以
He核聚变所释放出的能量相当于目前人类一年消耗的能量.在地球上,氦元素主要以 ![]() He的形式存在.下列说法正确的是( )
He的形式存在.下列说法正确的是( )
A.![]() He原子核内含有4个质子
He原子核内含有4个质子
B.![]() He和
He和 ![]() He互为同位素
He互为同位素
C.![]() He原子核内含有3个中子
He原子核内含有3个中子
D.![]() He的最外层电子数为2,所以
He的最外层电子数为2,所以 ![]() He的化学性质活泼
He的化学性质活泼
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机物的说法正确的是( )
A. 天然气为纯净物 B. 天然气是不可再生的能源
C. 乙烯的结构简式为CH2CH2 D. 过量的CH4和Cl2在光照条件下反应只生成CH3Cl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若NA表示阿伏加德罗常数,下列说法中正确的是
A. 常温、常压下,32 g O2和O3混合气体中含有2NA个原子
B. 常温下,5.6 g铁粉加入足量浓硝酸中反应,转移的电子数为0.3NA
C. 1 L 0.5 mol·L-1Na2CO3溶液中,阴阳离子总数为1.5NA
D. 16 g CH4与18 g NH![]() 所含质子数相等
所含质子数相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绿矾(FeSO4·7H2O)是治疗缺铁性贫血的特效药。下面是以商品级纯度铁屑(含少量锡等杂质)生产绿矾的一种方法:
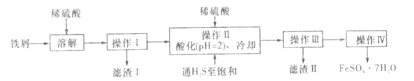
已知:在H2S饱和溶液中,SnS沉淀完全时溶液的pH为1.6;FeS开始沉淀时溶液的pH为3.0,沉淀完全时的pH为5.5.
(1)用KSCN检验绿矾晶体中是否含有Fe3+的离子方程式为:______________________。
(2)检验所得绿矾晶体中是否含有Fe3+的实验操作是_________。
(3)操作Ⅱ在溶液中用硫酸酸化至pH=2的目的是_________;通入硫化氢至饱和的目的是:
①除去操作I所得溶液中含有的Sn2+等杂质离子;
②______________________________。
(4)操作IV的顺序依次为:__________。
(5)操作IV得到的绿矾晶体需要洗涤,其目的是:①除去晶体表面附着的硫酸等杂质;②降低洗涤过程中FeSO4·7H2O的损耗。洗涤晶体的溶液可以是_____(填正确选项序号)。
a.冰水 b.饱和Na2SO4溶液 c.乙醇
(6)测定绿矾产品中Fe2+含量的方法是:a.称取2.8500g绿矾产品,溶解,在250mL容量瓶中定容;b.量取25.00mL待测溶液于锥形瓶中;c.用硫酸酸化的0.01000mol/L KMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为20.00mL(滴定时KMnO4溶液只与Fe2+发生反应)。
①计算上述样品中FeSO4·7H2O的质量分数为______(保留4位有效数字);
②若用上述方法测定的样品中FeSO4·7H2O的质量分数偏低(测定过程中产生的误差可忽略),其可能原因有_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把V L含有MgSO4和K2SO4的混合溶液分成两等份,一份加入含a mol NaOH的溶液,恰好使镁离子完全沉淀为氢氧化镁;另一份加入含b mol BaCl2的溶液,恰好使硫酸根离子完全沉淀为硫酸钡。则原混合溶液中钾离子的浓度为( )
A. (b-a)/V mol·L-1 B. (2b-a)/V mol·L-1
C. 2(2b-a)/V mol·L-1 D. 2(b-a)/V mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜与浓硫酸反应结束后,烧瓶中铜片未完全溶解。若向反应后的溶液中加入下列物质,相关推断错误的是( )
A.加入铁粉,铁粉溶解B.滴入NaNO3溶液,铜片不溶解
C.加入银粉,银粉不溶解D.滴入NaHCO3溶液,有气体产生
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com