
| A、CH4和NH4+ |
| B、N2O4和C2H4 |
| C、CO2和NO2 |
| D、H2O和CH4 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| 选项 | 待提纯物质 | 杂质 | 主要操作方法 |
| A | 溴苯 | 苯 | 加入铁粉和溴,过滤 |
| B | 碘水 | 水 | 用酒精萃取碘水中的碘 |
| C | 乙烷 | 乙烯 | 通入酸性高锰酸钾溶液,洗气 |
| D | 碘化钾 | 淀粉 | 多次渗析 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、沸点:H2O>H2S |
| B、溶解性:NH3(易溶于水)>PH3(难溶于水) |
| C、稳定性:H2O>H2S |
| D、等质量的体积:冰>水 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、乙烷(乙烯):KMnO4酸性溶液,洗气 |
| B、乙醇(乙酸):碱石灰,蒸馏 |
| C、甲苯(苯酚):浓溴水,过滤 |
| D、溴乙烷(乙醇):苯,分液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、非金属单质分子中一定含有非极性共价键 | ||||
| B、根据电离方程式:HCl=H++Cl-,判断HCl分子中存在离子键 | ||||
C、根据2C+SiO2
| ||||
| D、变化过程中化学键被破坏,不一定发生了化学变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 尿素(H2NCONH2)可用于制有机铁肥,主要代表有[Fe(H2NCONH2)6](NO3)3[三硝酸六尿素合铁(Ⅲ)].
尿素(H2NCONH2)可用于制有机铁肥,主要代表有[Fe(H2NCONH2)6](NO3)3[三硝酸六尿素合铁(Ⅲ)].查看答案和解析>>
科目:高中化学 来源: 题型:
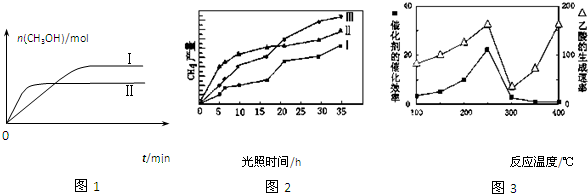
| 容 器 | 甲 | 乙 |
| 反应物投入量 | 1mol CO2、3mol H2 | a mol CO2、b mol H2、 c mol CH3OH(g)、c mol H2O(g) |
查看答案和解析>>
科目:高中化学 来源: 题型:
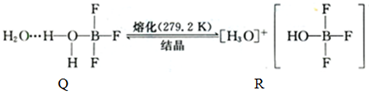
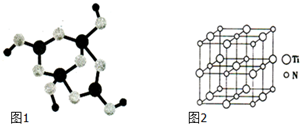
| 化学键 | Si-O | Si-Cl | H-H | H-Cl | Si-Si | Si-C |
| 键能/kJ?mol-1 | 460 | 360 | 436 | 431 | 176 | 347 |
| ||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com